
支原体(mycoplasma)属于细菌域原核生物界硬壁菌门中低 c、G含量的革兰阳性杆菌分支柔膜体纲(Mollicutes),是一类缺乏细胞壁的原核细胞型微生物 ,大小介于细菌与病毒之间,呈高度多形性,有球形、杆形、丝状、分枝状等多种形态。在细胞培养过程中,支原体感染发生率达30%~60%,随着细胞培养技术的广泛应用,组织、细胞、疫苗等受支原体污染的现象越来越普遍。
污染细胞最常见的支原体包括:发醉支原体(M.fementans)、猪鼻支原体(M.hyorhinis)、口腔支原体( M.orale )、精氨酸支原体( M.arginina )、梨支原体(M.pirum)、唾液支原体(M.salivarium)和人型支原体(M.hominis)。被这些支原体污染的细胞常常不引起明显的细胞病变,也不导致培养液浑浊,难以凭肉眼发现,因此,建立一种高效、快速、敏感度高的检测方法十分必要。
支原体的检测方法有很多种,《中国药典》中支原体检测方法包括培养法、DNA荧光染色法,其他方法还有酶法、PCR法、ELISA法、间接免疫荧光试验、生化检测法、直接血凝试验、探针法、放射自显影法等。每种方法各有利弊,不同方法的支原体检出率也有差别,一般在5% ~87%之间。本次讲述培养法、DNA荧光染色法、PCR法检测。
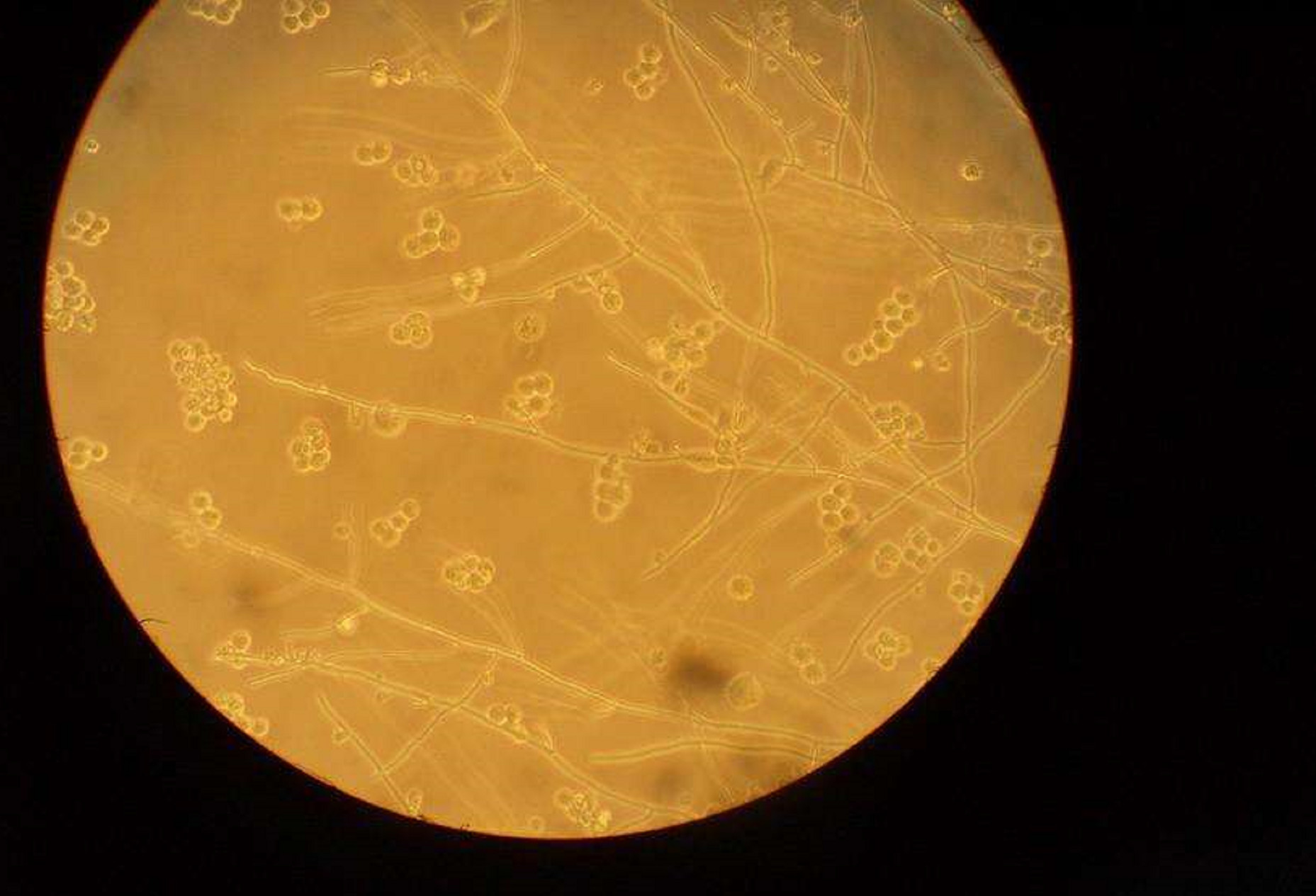
方法:配制支原体培养基,取1 mL细胞培养液,接种于液体培养基中,37 ℃培养,同时观察是否有混浊或pH值改变。2周后,分别取0.1 mL液体培养液涂在琼脂平板上,倒置于37 ℃厌氧箱培养,至少3周,持续观察是否有支原体菌落出现,有圆形无色透明菌落出现为阳性。
评价:此法是较早采用的方法。在固体琼脂培养基、半固体或液体培养基上培养 Vero、NIH3T3 等易被支原体污染的细胞株,可在其中分离到支原体菌株。培养法得到支原体菌株是最可靠的阳性指标。该方法的缺点是灵敏度低,不能检测到种属且不适用于检测所有支原体。
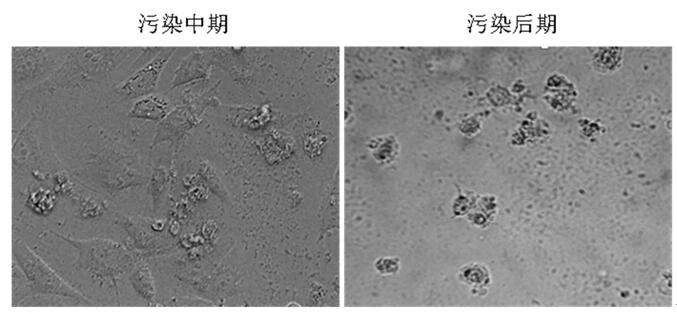
方法:
①制备标本。首先,在六孔板中制备盖玻片细胞培养物,然后将待测细胞接种到盖玻片上,用培养液培养 1 ~ 2 d。采用有支原体污染的细胞作阳性对照,无支原体污染的细胞作阴性对照。
②固定。首先,吸出培养液,用新鲜配制的 1∶3冰醋酸 /甲醇固定液固定 15 min;然后,吸出固定液后重复固定一次;最后,吸除固定液室温下干燥。
③染色。用 pH值 7.2的 PBS稀释Hoechst33258储存液,使终浓度为 5μg/ml;然后将染液滴加到固定好的细胞上,室温下避光染色 30 min。
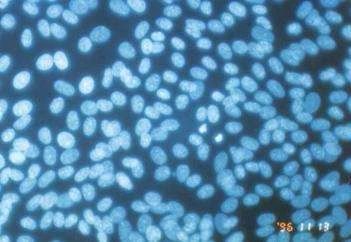
④洗涤。用双蒸水浸泡染色过的盖玻片 3次,每次 3 ~ 5 min。⑤封片。滴加 1滴含 50%甘油的柠檬酸缓冲液( pH值 5.5)到染色过的细胞表面,然后将盖玻片上有细胞的一面朝下,覆盖在载玻片上。⑥观察。在荧光显微镜下观察细胞的荧光分布状态,判断有无支原体污染及污染程度。
评价:利用荧光燃料 Hoechst33258 能与DNA 特异性结合的性质,在荧光显微镜下观察被支原体污染的细胞时,除细胞核外,在细胞膜上及细胞之间也有荧光颗粒。荧光染色法分为直接法和间接法两类,直接法即用染色剂将待测细胞直接染色;间接法指在无污染指示细胞中加入待测细胞上清液,进行混合培养后再染色,因此间接法的灵敏度高于直接法。
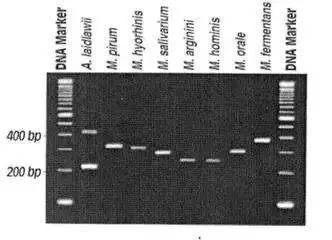
方法:采用酚氯法提取待测细胞DNA,引物为常见污染支原体种类16sRNA的保守区域序列,长度472 bp,引物A:5’-GGCGAATGGGTGAGTAACACG-3’,引物B:5’-CGGATAACGCTTGCGACCTATG-3’。PCR总反应体积为25 μL,加入PCR缓冲液、氯化镁、Taq酶、dNTP、模板和引物。扩增条件为:94 ℃预变性3 min,94 ℃变性25 s,58 ℃退火45 s,72 ℃延伸45 s, 循环30次后,72 ℃恒温7 min。取9 μl扩增产物与1 μl 10×Loading Buffer混合后,加入含0.5 μg/ml溴化乙锭的1.5%琼脂糖凝胶,75V电泳25 min,用紫外检测仪观察并用凝胶成像系统照相,有目的片段出现为阳性。
评价:PCR 法是目前常用的支原体污染检测方法,其原理是根据具有支原体种或属特征的核酸序列(一般用 16S rRNA)设计引物,经预变性、扩增、延伸后得到扩增产物,进行琼脂糖凝胶电泳实验后,通过凝胶上条带的位置进行判断待测物是否感染了支原体。PCR 法灵敏度高,检测时间短,操作简便,但仍然存在一定缺陷:如易出现假阳性或假阴性等。近年来出现了两步法 PCR 检测支原体污染的方法,即在第一次 PCR 的基础上,再进行第二次 PCR。其原理与 PCR 理相同,只是分别采用外引物 (outer p rimer) 和内引物 (inner primer) 分两轮进行扩增,相对于传统 PCR 法而言,其准确性、特异性和灵敏度均有所提高。
细胞制剂质控标准检测项目至少包括内毒素检测、无菌检测、支原体检测、细胞数量、细胞存活率、细胞表型等的检测。支原体检测在质检中也具有很重要的地位。支原体感染细胞后一般难于清除,事实上,被支原体污染的细胞,即使污染被清除,细胞原有的生物学特性,如基因的表达、抗原性和代谢特点也随之发生了相应的改变,会对研究结果造成严重影响。为了保证细胞体系免受污染的影响,关键是加强预防尽可能减少污染的发生,一般需要在培养液中加入抗生素;另外,清洁的实验室环境和良好的操作习惯,优质的试剂,如血清、培养基等都是很重要的。
产考文献: [1] 卢勇,贾继宗,唐静等.3种支原体检测方法的比较.中国生物制品学杂志.2015.10