
慢病毒载体(LV)在获得性及遗传性疾病的基因治疗中的应用越来越广泛。这篇综述介绍了生产这些载体最前沿的技术,尤其是涉及到临床应用的大规模生产技术。相比较于在稳定细胞系生产的逆转录病毒载体,临床级别的慢病毒大多是通过在细胞工厂瞬时转染293或293T细胞生产的。然而,最近的进展倾向于采用中空纤维管反应器、悬浮培养及改进的稳定细胞系生产。正如生物技术行业的惯例一样,慢病毒生产已经建立了比较复杂的下有处理规程,包括去除任何过程来源的污染如质粒、宿主细胞DNA或蛋白。这篇综述比较了已发表的慢病毒大规模生产和纯化工艺并介绍了它们的优缺点。此外,稳定细胞系领域的进展及它们作为临床材料生产载体的进展也一并介绍。
会议推荐:大咖齐聚上海|CAR-T细胞治疗研发及生产工艺论坛
这部分比较了文献报道的实验室规模和工业化生产规模的慢病毒的生产过程。这个比较主要集中在生产者的技术方法上。讨论每种方法的性能和产率是没有意义的,因为慢病毒系统、转的基因及滴度测定方法的差异导致无法进行客观比较。
以研发为目的的小规模生产是采用生长在培养皿、培养瓶、多盘系统(Cell Factories, Cell Stacks)或HYPERFlask的贴壁细胞。采用传统的磷酸钙转染或者最近发展起来的PEI转染来转染最佳密度的细胞(<50%),后者的优点是不依赖培养条件、转然后不需要换液及可用于悬浮细胞转染。原则上,小规模生产也可以采用阳离子转染试剂如lipofectamine、fugene及293fectin,它们转染也都获得了高水平表达。
通过比较不同的细胞培养系统,Aububel等并没有发现所评估的培养系统(培养瓶,一层或十层细胞工厂)所产生的慢病毒滴度有任何差异。利用HYPERFask,Kutner等发现采用HYPERFask培养可以比用传统培养装置培养所产生的慢病毒每个表面单位高10倍,原因可能是前者有更高的氧气利用率。此外,HYSPERFask生产的慢病毒比传统培养皿生产的慢病毒所含细胞蛋白、核酸污染更低。
HEK293T细胞贴壁不牢,所以采用转瓶培养生产慢病毒时更困难,同时为了要保证细胞贴壁,转染条件的优化要更加小心。在这种背景下,Patel等证实在HEK293中过表达alpha-v和beta-3整合素可以提高细胞贴壁能力,进而提高转瓶中慢病毒的产率。然而,这种方法需要采用过表达整合素的重组HEK293。
当转向临床实验时会需要大量的慢病毒载体,而将生产工艺放大则显得极为重要。这既可以通过扩展方法(增加生产单元),也可以通过采用悬浮培养系统实现,后者比贴壁细胞更容易放大。两种方法下面都会介绍:
大多数大规模生产都是小规模生产的直接放大,即通过增加培养/生产单元来实现。生产基本上采用大量的多层培养系统(Cell Factories(CF)(CF-10)(Figure 2))或者Cell Stacks(CS)。因为易于操作,10叠层装置(CS-10)是首选,虽然原则上40叠层装置同样也可以用,但是因为它重量增加的原因所以需要特殊的处理系统。此外,每层平板的气体交换及培养基层不可能一致,因此用显微镜控制40叠层装置细胞的生长很困难。生产要么采用放在层流工作台的开放模式,要么采用半封闭模式,后者对操作人员、环境及终产品的安全性更高。
 Figure2.Nunc公司的十叠层细胞工厂(CF-10)
Figure2.Nunc公司的十叠层细胞工厂(CF-10)
收获是通过简单的培养基置换完成的,在某些情况下,通过增加收获次数来提高最终慢病毒的质量。然而,在临床前及临床级大规模生产时,频繁收获是不现实的,因此在大多数时候只是收获1-3次。
根据10叠层培养设备的数量及收获次数的多少,传统上采用10-24个CF-10设备一次生产周期可以收获的体积介于20-52升之间。
在多次生产周期的生产规程中(多次亚批次系统),可以获得大批量的药品(纯化的和瓶装产品)。Ausubel等介绍了一种大体积(>100升)生产慢病毒的方法,该方法把几周内生产的多个10升的亚批次产品收集到一起。Dupont也使用了类似的方法。单独处理每次收获的样品纯化的产品每次都要进行质控。为了生产大量的药物产品,所需数量的纯化的分装品会经过解冻、汇集、无菌过滤并装瓶。
在稳定诱导型生产细胞系(tet-off诱导系统)条件下,50-LWAVE反应器(工作体积25升)在一次连续培养过程中可以收获138L含有慢病毒的细胞培养上清(收获时间:诱导后的8天内收获3-6次)(见下面)。
未处理的上清一般含有1-5×107个感染颗粒/毫升,与报道的小规模生产的滴度相仿。然而,Greene等及Ausubel等也分别报道采用大规模生产获得了0.5-1×107及0.5-2×106转染单位/毫升的病毒滴度。这些差异主要是受载体组成如目的基因、所用的启动子及其它的调控元件,同时也受滴定方法的影响,因为目前滴定方法还没有标准化。
所有的大规模生产规程都是针对HIV-1及EIAV慢病毒载体开发的。
最近报道了一种采用中空纤维的慢病毒生产系统,被称为准‘大规模’。首先将HEK293T接种到中控纤维中,贴壁24小时之后将三个质粒转染进HEK293T细胞。它的优点是它是封闭的全自动培养系统,并且产量与三个CF-10叠层相当。但是在实际生产中它需要建立多个平行系统。
Table 1罗列了可利用的大规模慢病毒生产体系。
虽然转染贴壁细胞是生产慢病毒的金标准方法,但是这个方法在扩大规模上受限。对工业化生产来说,在大的生物反应器中培养细胞通常是最便捷的方式。
在生物反应器中生产需要对悬浮的生产细胞扩大培养。多个用于生产慢病毒的细胞系(293T、293FT、293SF-3F6)被报道易于在化学成分限定的培养基(Freestyle 293 and F17, Invitrogen, Carlsbad, CA; HyQSFM4TransFx293, Hyclone, Logan, UT)中适应悬浮培养。这些细胞可以在没有为载体的情况下迅速悬浮生长,这使得它们的培养和扩大比贴壁培养的细胞容易很多。此外,培养基中没有牛血清及其他动物来源的组分是临床生产最合适的情况,它可以降低被外源物质污染的风险。
在悬浮培养模式下,细胞可以通过不同的容器进行扩大:摇瓶、玻璃生物反应器、不锈钢生物反应器、培养袋及一次性搅拌容器。有报道采用HEK293T细胞进行扩增、转染、慢病毒生产可以用一次性的生物反应器实现50L的规模。
采用磷酸钙沉淀的DNA转染悬浮细胞由于持续的搅拌而被认为效率低下。因此,大多数时候采用其它的转染试剂如阳离子聚合物。线性25kDa的PEI可以在293T及293-EBNA1中诱导最高的转染效率,用GFP质粒作为报告质粒可以达到75%的转染效率。在Marceau及Gasmi的关于生产慢病毒的专利中也采用了同样类型的PEI,他们达到了90%的GFP阳性细胞。然而在这个例子中,转染效率是在转染后48小时检测的,因此GFP信号可能来自新合成的慢病毒的感染。
为了在几个HEK293来源的细胞系中获得最佳的转染效率,细胞密度似乎是一个很重要的参数。许多文章一致认为PEI/DNA聚合物转染前细胞的最佳密度是1百万细胞/毫升,更精确点是介于8×105细胞/毫升至1.5×106细胞/毫升之间。
PEI转染的一个缺点是达到高转染效率所需要的质粒DNA的量。Ansorge等1ug/106 293SF-3F9细胞,而Marceau及Gasmi报道最佳的用量是2.5ug/106 293T细,这样在大规模制备时会需要大量的质粒(例如,一个200L的生物反应器需要750mg质粒DNA)。这么大量的DNA意味着原料成本过高,大量残留DNA需要在后续处理中去除。
PEI的另一个问题是在生产或纯化慢病毒时缺少检测及定量PEI的方法。因此,还不清楚PEI是否会和慢病毒共纯化,这种共纯化的水平及是否会对慢病毒的感染能力及稳定性产生破坏作用。
另外,有报道证实电穿孔可作为真核细胞的转染方法。Witting等报道采用电转可以高效的生产慢病毒。然而,这种方法需要在电转时将细胞浓缩到108/毫升,因此很难扩大到工业规模。事实上,现在的方法是在电转前浓缩,电转后稀释到原来的体积。更大规模的操作需要例如连续离心机等特殊设备。一般来说,细胞培养阶段的技术操作控制地越少越好,因为他们会增加微生物污染的危险。此外,离心也可能会导致细胞压力及大量细胞损伤,进而会降低病毒产量。因此,虽然很有前景,但是电转要想在工业规模获得应用还需要进一个完善和简化。
在前面瞬时转染悬浮细胞生产慢病毒的例子中,培养基中加入了终浓度为1-10mmol/L的丁酸钠。像其它组蛋白去乙酰化酶抑制剂如曲古霉素A、丙戊酸一样,丁酸钠据报道可以组织DNA凝集,从而使得启动子暴露出来。这样会提高RNA转录及后续的慢病毒产量。然而,丁酸钠的作用还存在争议,因为研究者之间慢病毒的产量并不一致。Ansorge等报道采用5mmol/L的丁酸钠将VSV-g包被的慢病毒的产量提高了10倍。与此相反,Sena-Esteves等采用10mmol/L丁酸钠并没有看到VSV-g包被的慢病毒的产量有任何提高,反而在其它包被类型的慢病毒中看到了产量提高。因此,很难做出组蛋白去乙酰化酶抑制剂作用的结论。这些实验的主要区别可能来自质粒载体本身,因为它们与组蛋白的相互作用理论上依赖于DNA序列及启动子的类型。因此,丁酸钠对每种DNA载体的影响应该单独评估。公布的数据表明,在悬浮培养的生产的慢病毒滴度类似于贴壁细胞获得的滴度。在批次收获或培养上清中获得的慢病毒滴度在107~108IG/ml或TU/ml范围内,而贴壁细胞系统获得的滴度在106-108TU/ml(Table 1)。然而,这种比较是非常困难的,因为可供比较的采用相同载体的报道数量少,不同的分析手段也是一个原因。
最后,在贴壁培养系统中,培养上清可以间隔一天收获两次,这是一个提高成本效益的好方法。在悬浮培养系统中,这种方法很难实现。Ansorge评估了一种灌注系统,该系统在7天中可以实现培养基替换和连续收获。他们的结果证实转然后48-96小时之间是慢病毒滴度最高的,说明在悬浮培养系统中多次收获也是可行的。虽然灌注系统在大规模时复杂且成本高,但是他对瞬时转染具有巨大吸引力。以为它可以在保持质粒用量不变的情况下,可以将收获体积扩大2-3倍。
总之,利用悬浮细胞瞬时转染大规模生产慢病毒是可行的,并且显示出良好的产量。但是,在转移到工业生产之前,该技术还需要进一步完善。优化的主要瓶颈是转染过程本身,它需要大量质粒DNA,从而使生产过程极其昂贵。一种工业友好、减少DNA的消耗、提高生产细胞的百分比的转染技术是使这一过程在未来工业中有利可图的关键因素。
如果没有展望中提到的改进,一旦用于慢病毒生产,稳定的生产细胞系将代表一个负担得起的生产系统。
相较于瞬时转染生产,稳定的慢病毒生产才是基因治疗的最佳选择。后者可以降低生产成本、提高整体安全性和可重复性,这也是限制瞬时转染技术大规模应用的主要障碍。首先为临床实验、最后为基因治疗产品商业化实现稳定的生产系统是降低生产成本、提高慢病毒质量和安全性的重要里程碑。自上世纪90年代初第一个包装细胞产生时,就发展出了很多构建策略,这些策略的主要差别在于选择导入编码基因的载体的方法。例如,质粒和整合载体以及所利用的包膜蛋白。后者已成为导致更多诱导性而非组成型包装细胞发展的最重要因素之一。VSV-g作为应用最广泛的慢病毒异源包膜蛋白,它有很强的细胞毒性。它的表达必须在慢病毒生产时诱导表达来防止包装细胞死亡。此外,HIV的gag和pol基因的表达也有细胞毒性和抑制细胞生长活性,因此这些基因的高表达必须控制在病毒生产阶段。第一个常用的诱导系统是Tet-on和Tet-off系统,它通过向培养基中添加或去除四环素/多西环素来作用于四环素反应元件(TRE)来诱导基因表达。当其它适合慢病毒包装的非毒性包膜蛋白被发现时,随后会开发出组成型包装细胞。这部分将分别讨论来源于HIV-1和EIAV的诱导型和组成型包装细胞,它们的性能指标总结在Table 2中。
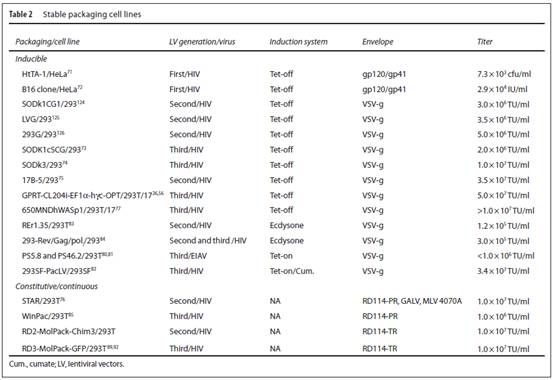
Tet-off诱导系统。四环素诱导表达系统在第一代包装细胞中就有应用,该系统中HIV gp120/gp41包膜蛋白还没有被VSV-g替换掉,调节性及非必需基因仍然保留在包装载体中。Hela来源的HtTA-1细胞组成型表达tTA,它是有大肠杆菌的四环素抑制子和单纯疱疹病毒的HSV-VP16反式激活因子融合的一个嵌合蛋白。tTA一方面控制所有包装基因的表达,另一方面也控制调节基因Rev蛋白的表达,而Rev会激活gag和pol基因。随后,Tet-off系统被用在基于HEK293的稳定包装细胞系SODk1中调控VSV-g包膜蛋白和第一代包装载体,该系统可以3-4天内生产滴度超过106TU/ml的病毒颗粒。随后两个独立的课题组构建了基于多西霉素抑制HIV-1 Rev/Gag/Pol及VSV-g包膜蛋白的第二代稳定细胞系,它们生产的慢病毒滴度在3.5-5×106TU/ml。此外,Tet-off系统也被用于在SODk1细胞中表达条件型SIN慢病毒,随后用于SODk3第三代包装细胞系中,该系统去除了HIV-1Tat反式激活蛋白及除了Rev之外的非必需基因。在这个cSIN转移载体系统中,U3转录调控元件被Tet反应元件TRE替代。这种载体设计保留了SIN的特征,同时只能在表达Tet调控的反式激活因子tTA的细胞中生产慢病毒。标准的SIV转移载体必须要通过质粒转染整合到稳定包装细胞中来避免逆转录后5’LTR失活,与此相反,cSIN转移载体可以通过转导进入细胞。事实上,逆转录发生之后,在多西霉素存在下,TRE会引导载体中含有包装信号的前病毒全长基因组转录来进行慢病毒包装。Tet调控的SODk1和SODk3包装细胞转导cSIN转移载体之后,会分别生产出高浓度(>106TU/ml和1×107TU/ml)的cSIN重组载体。
-Pol基因的密码子进行了优化来减少同源重组的发生。这种新方法虽然降低了包装基因和VSV-g的总体毒性,但是它仍然不能抑制p24Gag的渗漏表达。含有抗HIV包膜蛋白基因反义核酸的VRX496载体可以在超过11天的时间内生产出最高浓度相当于3.5×107TU/ml和p24Gag 300ng/ml的慢病毒。并没有检测到有复制能力的慢病毒,但是长期分析发现培养2-3个月之后有部分基因沉默。Virxsys及其它讨论的包装细胞是采用质粒构建的,这些质粒随着时间推移经常会发生沉默,这也可以解释慢病毒的短期稳定性。为了克服这些问题,2003年Ikeda及2009年Throm报道了采用整合型MLV载体作为整合型载体基因的导入工具。St.Jude用于治疗X连锁重症联合免疫缺陷疾病的技术是基于构建可诱导的第三代293T来源的GPR(gag-pol-rev)和第二代GPRT(gag-pol-rev and tat),在上述系统中,Rev和Tat的表达受Tet-off系统紧密调控。高表达的Rev基因会诱导其它的包装基因、VSV-g基因和SIN转移载体CL204i-EF1α-hγc-OPT,后者表达密码子优化的IL-2Rγc的cDNA,并且其两端有400bp鸡β球蛋白HS4的绝缘子序列。Ikeda报道的原始方法利用LTR驱动MLV,而Throm及其合作者应用SIN-MLV载体来避免LTR-MLV包装基因组被包装进慢病毒颗粒。该方法引入的另一个创新点是为连接有抗生素抗性基因的SIN载体基因组整合而开发的连环阵转染技术。表达GFP或IL2RG基因的生产细胞可以生产出滴度超过5×107TU/ml的上清。如前所述,按照支持X连锁重症联合免疫缺陷疾病临床试验的规模分两次生产的大约280L CL204i-EF1α-hγc-OPT慢病毒,经浓缩之后,其滴度达到4.5和7.2×108TU/ml。
St.Jude儿童研究医院利用GPRGT包装细胞及表达Wiskott-Aldrich综合症蛋白的650MNDhWASp1包装细胞生产临床级别的VSV-g包被的Wiskott-Aldrich综合症慢病毒。为了获得生产细胞,将U3区含有HS4染色质绝缘子的转移载体采用一种改进的方法导入到细胞,该方法是在Throm的基础上改进的。将hWASp 单体连接到博来霉素抗性基因而不是更长的连环阵列稳定转染GPRGT细胞。该细胞克隆可以生产滴度超过1×107TU/ml未浓缩的慢病毒,并且在连续传代时可以稳定生产超过8星期。
据我所知,到目前为止,只有GPRG-EF1α-hγcOPT包装细胞已经用于临床试验,而650MNDhWASp1细胞仅仅打算最近用于临床试验,该研究是由St.Jude儿童研究医院开展的。
最近,第一个生产整合型缺陷慢病毒载体的稳定包装细胞由Tal Kafri小组开发出来。该包装细胞是通过转染含有整合酶D64E突变体的四环素调控的包装载体pTK1574和VSV-g基因进入PVG3细胞,该细胞稳定表达反式激活因子tTA。生产细胞的建立要么通过转导cSIN转移载体(滴度:107TU/ml),要么通过稳定转染一个新的多聚嘌呤位点缺失的转移载体(滴度:108TU/ml)。这两种整合缺失的慢病毒载体都适合体内转导大鼠纹状体中的神经元。
Tet-on诱导系统。Oxford BioMedica在293T细胞表达的EIAV慢病毒的基础上开发了一种稳定包装细胞系和一个Tet-on诱导系统,在该系统中,向培养基中添加多西霉素之后,Tet抑制子(TetR)紧密调控VSV-g和Gag/Pol的表达。该系统与Tet-off系统相比渗漏表达更低。EIAV转移载体编码一个治疗帕金森氏症的基因治疗产品:ProSavin。两种ProSavin生产细胞PS5.8和PS46.2被详细鉴定,它们即使在没有选择压力的情况下也可以稳定培养49天。病毒的滴度平均小于106TU/ml,与瞬时生产系统相当。
Tet-on/cumate诱导系统。Tet-off诱导系统不能完全消除VSV-g的渗漏表达从而导致细胞毒性及包装细胞不稳定,因此开发了一种叫293SFPacLV的双开关系统。该细胞来源于在无血清悬浮培养基中生产慢病毒的293SF细胞。293SFPacLV细胞表达cumate开关系统的CymR抑制子及Tet开关系统的反式激活因子rtTA2S-M2。基因诱导是通过向培养基中添加多西霉素和cumate诱导剂来实现的。在转导表达GFP的cSIN慢病毒到包装细胞之后,生产细胞可以产出3.4×107TU/ml的慢病毒。然而,尽管GFP标记基因获得了令人鼓舞的结果,但这些细胞从未进入临床研究阶段。
蜕皮激素诱导系统。该系统是基于昆虫蜕皮激素类似物蜕皮激素A,被用于四环素调控技术的替代技术。蜕皮激素A反应性293T细胞系中,gag、pol、rev和VSV-g的表达是由诱导型蜕皮激素启动子的控制之下。这种细胞不断产生二代慢病毒,经浓缩后可以达到108TU/ml。
与此类似,293-Rev/Gag/Pol细胞系是将HIV rev和gag/pol基因分别置于独立的蜕皮激素诱导型启动子下,然后导入293细胞。在筛选时,该细胞持续加入HIV特定的蛋白酶抑制剂 Saquinavir来控制HIV蛋白酶的细胞毒性。诱导后48小时之内,293-Rev/Gag/Pol细胞释放出大量的HIV Gag/Pol颗粒(大约10ug p24/ml),它可以将第三代HIV载体包装到很高的滴度。
毫无疑问,具有高产量的组成型(或连续型)包装细胞的获得要比诱导型细胞难获得的多。事实上,载体基因的毒性使得VSV-g包膜蛋白或筛选p24Gag高表达蛋白变得不可行。因此,这种类型包含仅仅带有不是VSV-g的包膜蛋白的包装细胞,它们与诱导型细胞比起来通常产生比较低的p24Gag。第一个名叫STAR的连续型包装细胞系是由Ikeda于2003年开发出来的。STAR引入了多方面创新:(i)测试了三种gamma逆转录病毒的包膜蛋白:R-多肽切割位点引入HIV蛋白酶位点的猫科动物的内源性γ逆转录病毒RD114包膜蛋白(RD114-Pro),带有MLV的胞质尾的长臂猿白血病病毒(GALV+),MLV 4070A (Ampho)包膜蛋白。(ii)通过MLV整合载体而不是质粒稳定转染来导入包装基因。(iii)除了293T细胞,还测试了Hela和HT1080细胞。Gag-pol基因在MLV LTR的转录调控之下,而其它的载体基因通过标准质粒表达。STAR技术适用于生产第二代和第三代慢病毒,可以连续3个月生产出最高到850ng/ml的p24,其浓度达到107TU/ml。然而,没有STAR来源的生产细胞到达临床应用,因为它可能将编码Gag-Pol和Rev基因的MLV基因组错误包装到慢病毒颗粒。随后发展的WinPac细胞中的SIN-MLV载体联合重组酶介导的表达盒交换技术(RMCE)降低了这种可能性。RMCE首先采用整合转移载体的稳定γ逆转录病毒包装细胞来交换不同的转基因,而在WinPac细胞中,RMEC技术被用于整合包装基因。一个表达GFP标签的SIN-MLV载体用来筛选293FT细胞中最佳的表达位点,用一个靶向载体将GFP表达盒与密码子优化的HIV-1 Gag-Pol表达盒交换。虽然RMCE是一个筛选基因组中开放转录位点的非常有用的方法,但是在这里是用它似乎有点多余,因为筛选出来的支持GFP高表达的细胞不能支持具有细胞毒性的Gag-Pol基因产物的持续高表达,更重要的是,无论采用什么导入方法,最好的Gag-Pol表达位点可以非常简单直接的采用p24Gag ELISA检测细胞上清来筛选。没有毒性的包膜蛋白RD114-PR、rev基因及载体基因组质粒被顺序转染到生产细胞,然后用抗生素筛选。获得了超过106TU/ml的慢病毒,经过浓缩之后可以提高到108TU/ml。降低胎牛血清的浓度到1%并在HYPERFlask中扩大培养,获得了持续到第六次收获、浓度超过5×106TU/ml的慢病毒。
另一种组成型包装技术是以MolMed S.p.A开发的RD-MolPack细胞为代表。RD-MolPack系统与STAR、WinPax细胞类似,也是基于HEK-293T细胞开发的,也表达RD114包膜蛋白。与WinPac的RD-114-PR包膜蛋白不同,RD-MolPack细胞带有RD114-TR包膜蛋白,该蛋白含有RD114蛋白的胞外和穿模结构域并融合有MLV-Ampho4070膜蛋白的胞质尾巴,从而利于整合入慢病毒载体。RD-MolPack细胞独一无二的地方在于,HIV-1 gag、pol、rev及潮霉素抗性基因是通过将嵌合baculo-AAV感染293T细胞导入的。细胞首先转染表达AAV Rep78的质粒来引导baculo-AAV载体整合入基因组。产生的表达两个拷贝gag-pol-rev基因的中间克隆PK-7显示出极高的遗传稳定性,它可以在有或没有潮霉素筛选的情况下连续培养一年,其生产的p24Gag水平分别为6.7±3.5和15.3±8.4ng/106 细胞/天。从PK-7细胞分别独立衍生出RD2-MolPack和RD3-MolPack来分别生产第二代和第三代慢病毒。与St.Jude儿童研究医院的MolMed的策略类似,包膜基因和Tat基因(仅指RD2-MolPack细胞)是通过VSV-g包被的SIN-LV而不是SIN-MLV整合载体导入的。在构建包装细胞中使用MLV或者HIV SIN的重大安全问题是遥远的,但现实的可能是在新产生的慢病毒颗粒中动员了载体基因(env或gag-pol)。事实上发现,SIN-LV 真载体整合时东动员频率在0.1-0.03%左右,而SIN-MLV则会有一些痕量的3’LTR启动子活性。利用特殊的实验已经排除了上述安全问题及产生有复制能力慢病毒的可能。RD2-MolPack-Chim3生产细胞,表达抗-HIV chim3治疗基因(HIV Vif的显性负性突变体),其产生的慢病毒超过了瞬时转染人脐带血造血干细胞所生产的VSV-g包被的慢病毒。从RD3-MolPack-GFP生产细胞生产的表达GFP的SIN-LV可以转染90%的人外周血淋巴细胞,其MOI=3,水平与VSV-g包被的瞬时转染获得的慢病毒相当。有意思的是,RD2-和RD3-MolPack细胞生产的慢病毒滴度(106TU/ml,浓缩后108TU/ml)比通过用RD114-TR包膜蛋白瞬时转染生产的慢病毒的滴度高。
上述展示的不同系统不能简单的进行比较,因为大多数情况下,细胞生产能力指标TU或ng p24/细胞/天并不是标准的分析方法。对于稳定的包装细胞,细胞生产力必须毫无疑问地考虑,这是使一个稳定的系统有价值或没有进一步发展的最重要的参数之一。低生产力的细胞可以通过慢病毒载体的高感染力来补偿,而这通常与高转导效率有关。
下游回收过程应以最低的成本为产品提供所需的浓度、纯度和其他质量属性。这一说法适用于所有大规模的制造过程,但往往不适用于研究目的的小规模净化规程。
大多数研究级别的慢病毒是通过批次浓缩而不是粗制剂之后应用的,浓缩基本上是通过两步离心法产生的。在70000g通过超速离心浓缩后的慢病毒再通过蔗糖缓冲(50000g)纯化,然后溶解在配方缓冲液中。一种改进,特别是纯度方面的改进,代表了基于离心/色谱联用的纯化方法。例如,Kutner等评估了组合纯化/浓缩方法。蔗糖缓冲的超速离心结合阴离子交换层析获得了88.2%的收率,而相反的组合则获得了77.6%的收率。在两种方法中,浓缩都超过了100倍,病毒滴度都超过了1010TU/ml(VSV-g包被的慢病毒)。
这些方法最大的缺点是它们无法进行放大,最后病毒的纯度由于细胞、培养基组分或者处理过程引入的污染而达不到体内应用。浓缩之后的慢病毒潜在地可能会在体内导致副作用或转导效率降低。因此,基于色谱和膜分离的技术的纯化方法被开发出来。其优点是,这样的净化方案可以以可扩展的方式开发,并且可以实现对慢病毒的工业级净化。在这一背景下,几个研究小组已经表明,基于色谱和膜分离方法的纯化方法不仅保证了载体安全性,而且显著提高了载体效能。γ逆转录病毒和慢病毒下游加工原理的总体概述已经由Segura和Rodrigues等人发表。
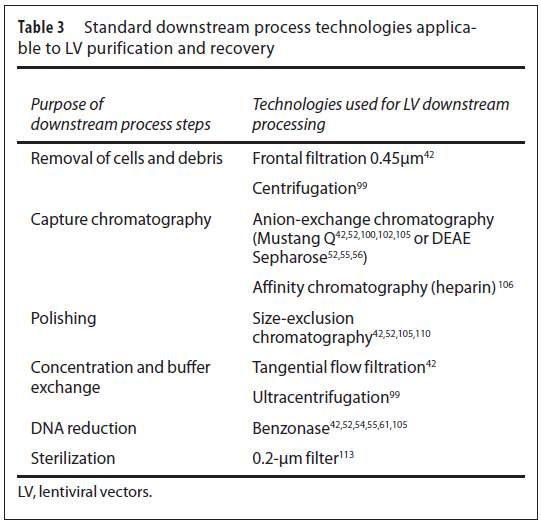
考虑到工业应用,在生物技术行业传统上使用的工艺步骤已经开发用于慢病毒的下游处理。它们是基于膜(过滤/澄清,利用切向流过滤进行浓缩/渗滤,基于膜的色谱)和色谱(离子交换色谱,亲和色谱,体积排阻色谱)的技术。这些不同的过程步骤的组合是可变的,在某些情况下,不同的净化原则可以用于相同的目的。此外,采用benzonase/DNase降解污染的DNA要么是是下游处理的一个步骤,要么在病毒生产阶段已经处理过。
原则上,可以区分三个阶段:(i)从粗病毒产品或澄清的细胞培养基中将靶分子捕获是纯化的第一步。(ii)中间纯化包括在捕获和优化阶段对澄清的粗产品进行的步骤,这些步骤去除特定的杂质。(iii)抛光是最后的步骤,目的是去除微量杂质和杂质,使活性和安全的产品以适合配方或包装的形式存在。在这一阶段的污染物往往是«构象»到目标分子,微量的杂质或疑似渗漏的产品.实际上,任何类型的色谱和超滤都用于中间提纯和最后的抛光步骤。
报道的用于慢病毒下游处理的技术总结在Table 3中。各个研究团队之间最大的差异是靶分子捕获阶段。Scherr、Yamada 、 Slepushkin、Bellintani、Merten 、Greene等证实可以用阴离子交换色谱来纯化VSV-g包被的慢病毒,而大规模纯化步骤是基于低压柱层析或基于膜的阴离子交换层析。当被用作第一步纯化时,这种膜盒可以最多每天纯化1500L样品。扩大规模可以直接获得纯的慢病毒(如去掉超过98%污染的蛋白和DNA);然而,慢病毒的复性并不像超离那样高效。色谱基质的低回收率是由于LV脆性施加的限制性工艺条件所致。事实上,慢病毒对pH变化及高盐浓度非常敏感,而这两个指标正是离子交换色谱优化结合和洗脱脱条件经常改变的。
此外,Segura等人开发出一种基于肝素的亲和色谱柱。利用这种方法,超过94%的蛋白杂质和56%的残留DNA被去除,而慢病毒的回收率有53%。尽管这些数据很有希望,但是这种色谱介质不是工业生产合适的选择,因为它含有动物来源的组分肝素。
为了浓缩大批量样品(上清或中间产品),切向流过滤系统备用来渗滤或缓冲液交换及配方。在工业下游处理规程的后期阶段或小规模处理,使用一次性离心设备和较大规模的中空纤维或平膜盒。切向流过滤也成功用于浓缩和渗虑非VSV-g包被的慢病毒。根据治疗适应症(即在体内给药或在体外应用),浓度倍数将显著变化。果向脑内注射慢病毒,例如Oxford Biomedica采用Prosavin治疗帕金森氏症,慢病毒需要高度浓缩,因为大脑能注射的体积是非常小的。在这种特殊情况下,两次切向流过滤可以获得超过108TU/ml滴度的慢病毒。因此,切向流过滤是纯化的最终步骤,因为如果加入任何如0.2um过滤的步骤都会显著降低得率和浓度。最后,体积排阻色谱可以用作最后抛光步骤,因为它可以高效地去除所有小于色谱基质颗粒的杂质。750kDa(相当于50nm)是可用于排除任何慢病毒颗粒(大小:80-120nm)潜在停留最大孔径。然而,该方法最大的缺点是会将慢病毒浓度最少稀释3倍。很多大规模纯化规程都将体积排阻色谱作为最后的抛光步骤。
Figure 3展示了一些大规模纯化的规程,其中一些细节可以看到。可以分辨出哪些规程从小规模纯化到大规模纯化的变化多或者少,还有可有有些大规模纯化规程没有任何色谱步骤(贝克曼研究所采用),有些是不同分离方法的组合(至少含有一个色谱步骤)。
慢病毒大规模纯化的常用捕获步骤包括:用膜过滤澄清(见Figure3),随后用切向流过滤/超滤(贝克曼研究所)或者体积排阻色谱(Virxsys, Généthon/MolMed, Oxford BioMedica/Henogen, St. Jude Children’s Research Hospital)来浓缩。除了一个用稳定细胞来生产慢病毒外,其它的操作规程都采用benzonase步骤来降低细胞残留的、质粒来源的DNA污染。然而,这个步骤在贝克曼研究所、Généthon/MolMed、Oxford BioMedica/Henogen的方法中用在捕获步骤中;而在Virsys的方法中则用在捕获之后。这两种方法各有利弊:先用benzonase步骤的优点是可以去除大的DNA片段,并且下面的步骤可以去除残留benzonase;然而所用的benzonase的量也非常大。与此相反,将benzonase步骤后置的优点是可以大幅降低benzonase的量(成本降低);然而,后面的步骤必须有将benzonase去除到检测不到的水平的能力。此外,后期用benzonase的缺点是大分子的核算污染可能会结合慢病毒颗粒形成沉淀,进而导致慢病毒在后续的步骤中丢失。
贝克曼研究所开发的纯化规程的特征是只有一个额外的纯化步骤(中间纯化=抛光步骤),即超速离心步骤。其它的所有规程都利用浓缩/渗滤步骤(最为中间纯化步骤)及最后的渗滤(Virxsys,Oxford BioMedica/Henogen)或体积排阻色谱(Généthon/MolMed)作为抛光步骤。
大多数操作规程的最后步骤是采用0.2um的膜过滤。这是在GMP条件下降低最终产品微生物污染风险的标准法规要求。虽然强烈推荐无菌过滤,但前提是该过程必须被证明是完全无菌的。这就需要无菌工艺验证,这是通过介质的工艺实验来完成,该操作必须在符合Class100(美国)或Grade A(欧盟)标准的环境内进行。
虽然过滤是保证产品无菌灌装前的最方便的方法,由Oxford BioMedica开发的下游处理工艺已经将该步骤放在第一个切向流过滤浓缩之后及最后一个切向流过滤步骤之前,从而降低因在慢病毒高浓度下被膜吸附而导致的丢失。
最后,有一个大规模纯化工艺没有最后的无菌过滤步骤,因为该生产工艺是在半封闭系统内完成的。在这种情况下,每个子批次都进行无菌检查,只有在无菌性得到验证后才进行集中。
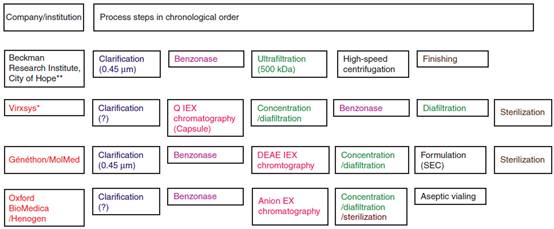 Figure 3. VS V-g包被的慢病毒大规模纯化下游工艺的主要步骤(临床应用)。红色显示的公司/研究所说明他们的下游处理工艺利用了离子交换层析。(?)-没有该过程步骤的详细信息(例如过滤步骤,没有说明孔径/排阻孔径)。除菌-除菌过滤(0.2um)。*Greene等在纯化稳定细胞系生产的临床材料时采用了一种没有benzonase及下游渗滤步骤的相似的纯化工艺。**Ausubel发表的工艺没有用最后的除菌过滤,因此每批次或亚批次样品在最终处理和进一步应用前需要独立进行无菌检测。LV:慢病毒载体;SEC:体积排阻色谱;TFF:切向流过滤;VSV-g:水泡性口炎病毒糖蛋白。
Figure 3. VS V-g包被的慢病毒大规模纯化下游工艺的主要步骤(临床应用)。红色显示的公司/研究所说明他们的下游处理工艺利用了离子交换层析。(?)-没有该过程步骤的详细信息(例如过滤步骤,没有说明孔径/排阻孔径)。除菌-除菌过滤(0.2um)。*Greene等在纯化稳定细胞系生产的临床材料时采用了一种没有benzonase及下游渗滤步骤的相似的纯化工艺。**Ausubel发表的工艺没有用最后的除菌过滤,因此每批次或亚批次样品在最终处理和进一步应用前需要独立进行无菌检测。LV:慢病毒载体;SEC:体积排阻色谱;TFF:切向流过滤;VSV-g:水泡性口炎病毒糖蛋白。
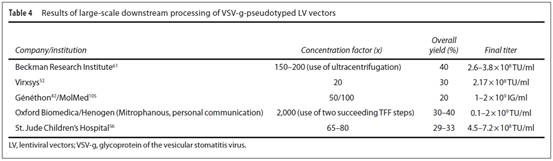
下游处理工艺的性能如下:除了贝克曼研究所用超速离心开发并发表的浓缩150-200倍的方法(Table 4),其他所有工艺的浓缩指数都是10-80之间。Oxford BioMedica开发的工艺的特点是利用连续的两次浓缩/渗滤(TFF)达到了浓缩指数2000。总体的回收率在20-40%。所有的纯化工艺得到了可比较的慢病毒浓度,即1×108-2×109ip/ml。这些大的差异主要是由于预纯化病毒的滴度、为标准化的滴定方法及病毒质粒载体(启动子、所转的基因)
除了获得载体的滴度及产量,慢病毒批次更关心的指标主要是各种污染物的去除。总DNA污染的去百分比在99.1-99.84%,总蛋白污染物的去除百分比在99.85-99.9%。针对宿主细胞的DNA及蛋白,有报道其去除百分比分别为99.8%和99.4%。因为不仅残存的DNA可能是个问题,而且DNA的大小以及由此引起的可能转移整个有功能的开放阅读框也是问题,因此监管机构对残存DNA污染的最大分子量的要求越来越高。例如,FDA的指南‘用于生产用于传染病适应症的病毒疫苗的细胞基质和其他生物材料的特性和鉴定’中说明,残留的细胞宿主的DNA片段不能超过一个功能基因的长度,估计在200bp左右。在这种情况下,Ausubel等人报道了其大小分布在小于500bp的范围。
除了质量控制要求,所有的连续细胞系产生的生物技术产品、慢病毒批次以及在载体生产结束生产细胞中必须要分析是否有有复制能力的慢病毒,它们可能是通过同源重组产生。虽然事实上目前的慢病毒生产工艺利用分裂的包装质粒基因组,它们之间很少或没有序列重叠,有复制能力的慢病毒重来没有观察到过,但是必须要用非常灵敏的方法去证明每批次慢病毒没有有复制能力的慢病毒。在这种背景下,利用稳定细胞系为提供更高的安全性,因为生产可以从有很好指控的细胞库开始,生产结束之后的细胞系也更容易检测有复制能力的慢病毒。
慢病毒介导的基因治疗将会很快成为不仅是罕见遗传病,也会是血液肿瘤、HIV等感染性疾病的常规治疗方法。将会有大量的病人等待治疗,因此可扩大的慢病毒生产工艺的改进变得越来越迫切。这种迫切性不仅在研究机构和医院,而且也在工业化生产领域,该领域正朝着这种医疗产品快速前进。
显然,标准的转染包括基于悬浮细胞的转染是不足以为将来常规治疗提供足够的慢病毒的,它只能作为一个折中方案。大量慢病毒生产的最终方案是悬浮培养的稳定生产细胞技术的改进,从而可以实现无限扩增。
过去几年在稳定包装领域有了几个大的进展:(i)采用整合载体而不是质粒来导入载体基因;(ii)包装基因的密码子优化来去除同源序列,从而降低产生有复制能力的慢病毒及ψ-gag重组的可能性;值得一提的是,据我们所知,即使采用密码子没有优化的基因,也没有有复制能力慢病毒的报道。(iii)比诱导型细胞更简单安全的组成型包装细胞系的开发;(iv)将转移载体简化整合进细胞的cSIN-LV系统的开发,虽然它只能用于可诱导系统;(v)RMCE技术在慢病毒系统中的应用。RMCE的重大贡献可能在于转移载体的整合,它可以在相同的基因位点切换不同的转基因。
还有很多问题等待回答:绝大多数稳定系统是采用GFP标记基因开发的,只有少数采用了治疗性基因。有必要收集更多的治疗基因的数据,以了解转基因的表达如何影响细胞生产力。此外,有没有除了HEK293T之外的替代细胞作为起始材料?慢病毒生产过程中的自我转导是安全的吗?去除生产细胞膜中慢病毒包膜受体会不会抑制自我转导或慢病毒聚集而不影响生产细胞的功能?
虽然VSV-g具有静息或刺激条件型进入任何细胞的能力,但是它的应用倾向于用于体外而不是体内基因治疗以避免非靶细胞转导时的毒性。事实上,即使转移载体中含有特定的启动子或特定的miRNA靶序列来控制转基因的表达,慢病毒在非靶细胞中整合的可能的基因毒性任然不可避免。此外,如果直接注入血液(静脉注射),VSV-g包被的慢病毒容易被人的补体降解,然而,这不妨碍VSV-g包被的慢病毒在局部给药时高效转导(例如中枢神经系统、肝脏疾病或者血友病的治疗)。为了降低采用VSV-g包被的慢病毒的缺点,抗补体的替代蛋白如RD114-TR和RD114-PR已经在稳定系统中检测,而其他仅在瞬时表达系统中研究的优秀候选蛋白也有待于在稳定的包装细胞系中进行验证。在这些蛋白中,最有前景的包括狒狒内源性逆转录病毒糖蛋白,该蛋白与RD 114一样同属于beta-逆转录病毒家族。最近证实,狒狒内源性逆转录病毒可以高效转染静息的血液造血干细胞。然而,来自CD133分子的特异性单克隆抗体scFv作为慢病毒的包膜蛋白来选择性转导体外具有高增殖潜能的造血干细胞和体内多能干细胞移植物。最后,麻疹病毒血凝素(H)和融合(F)糖蛋白H/F在高浓度的麻疹病毒阳性的人血清中可以高效的转导静息T、B淋巴细胞。虽然其它备用膜蛋白比VSV-g的特异性要高,但是必须记住,它们不是完全特异的,因为能够表达env蛋白所识别的特定受体的所有细胞都可以被转导,这更加彰显了对体内直接给药进行仔细评价的重要性。
尽管取得了这些进展,但是在这些慢病毒可以常规用于临床前和临床研究之前,还有重要的涉及纯化方法放大的障碍需要解决。最近Boudeffa报道了纯化GaLV-TR包被的慢病毒的成果。
总之,最近在临床试验中成功使用慢病毒治疗稀有和后天性疾病,以及载体和生产技术的进步,将使这一有前途的载体系统造福于人类。
参考文献: Otto-Wilhelm Merten, Matthias Hebben and Chiara Bovolenta.Production of lentiviral vectorsMolecular Therapy — Methods & Clinical Development (2016) 3, 16017;