
2019年7月25日/医麦客 eMedClub/--昨日,加拿大团队在自然杂志上发表了一篇名为A mutation-independent approach for muscular dystrophy via upregulation of a modifier gene 的研究论文,该研究团队开发了一种基于CRISPR的基因激活技术,该方法在小鼠中在不使DNA中双链断裂情况下上调与MDC1A(先天性肌营养不良症1A型)相关基因Lama1的表达,而不是传统的直接针对导致MDC1A的突变基因Lama2,应用该疗法后发现其能够预防和逆转小鼠肌肉萎缩症状,最重要的是,无论该疾病突变类型如何,该疗法都可进行治疗。
 图片来源:nature
图片来源:nature
先天性肌营养不良症(CMDs)是一类遗传性神经肌肉疾病,其亚型先天性肌营养不良1A型(MDC1A)是由编码层黏连蛋白α2的Lama2基因突变引起,突变后Lama2产生无功能的层粘连蛋白-α2,这种蛋白会损害肌纤维的稳定性以及周围神经髓鞘的形成,最后会导致严重的肌肉萎缩和瘫痪。
目前已确定的引起MDC1A的Lama2突变超过350个,这意味着需要针对其每个突变进行设计并且进行评估的多种此类疗法,而增加Lama1的表达以产生与Lama2编码的蛋白质结构相似的蛋白质可能有利于所有MDC1A病例。
目前Lama1本身还存在着局限,该基因因太大而无法被在传统上用于传递基因疗法的病毒载体运载,因此,该研究团队人员再次转向CRISPR,并开发了以增加Lama1的表达一种基因激活系统,重要的是,该方法不会使DNA双链断开。
在该项研究中,其研究人员运用携带催化失活的Cas9(dCas9)、VP64反式激活因子和靶向Lama1启动子的单向RNA的腺相关病毒(AAV9)调节MDC1A的dy2j / dy2j小鼠模型中Lama1的表达。运用该疗法后不仅可以预防症状前小鼠的瘫痪,而且也改变了已经出现症状的动物的疾病进展。
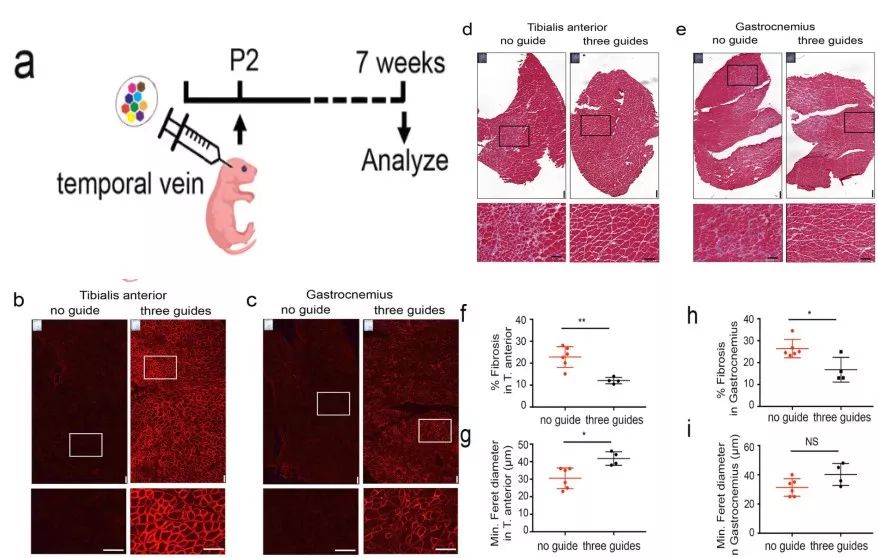 上调Lama1的早期干预可预防dy2j/dy2j小鼠的疾病进展
上调Lama1的早期干预可预防dy2j/dy2j小鼠的疾病进展
其研究表明,当疗法应用到未出现MDC1A症状小鼠中时,Lama1在骨骼肌和周围神经中被上调,从而阻止肌肉纤维化和麻痹,防止了症状发。更重要的是, 在当有明显的后肢麻痹和肌肉纤维化的症状的dy2j / dy2j小鼠进行治疗时,其发现该疗法还可以使动物站立起来并可以移动,此外,研究人员还观察到神经传导速度显著增加,据信这将有助于恢复髓鞘和改善神经肌肉功能。
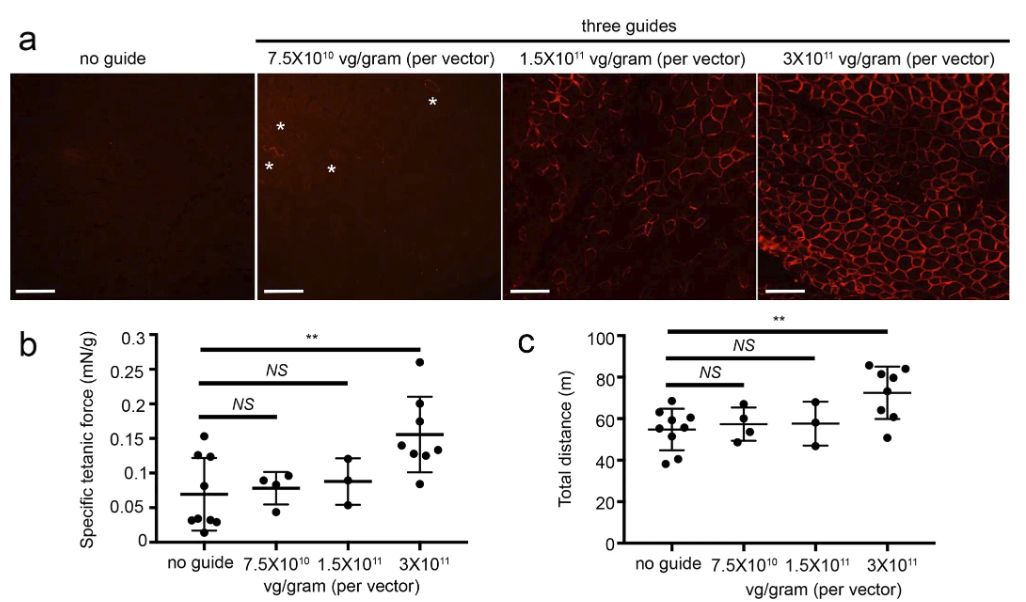 Lama1的上调肌肉功能的改善对应关系dy2j/dy2j小鼠的疾病进展
Lama1的上调肌肉功能的改善对应关系dy2j/dy2j小鼠的疾病进展
早前,就有研究人员利用CRISPR在小鼠体内成功地治疗MDC1A这种罕见疾病,他们能够通过校正一种导致这种疾病的剪接位点突变恢复了这些小鼠的肌肉功能,
CRISPR也在DMD(杜氏肌营养不良症)取得了积极的临床前结果,其主要靶向产生肌营养不良蛋白基因突变。
此外,在杜克大学一项由DMD制药商Sarepta支持的研究中,科学家使用CRISPR去除功能失调的肌营养不良蛋白外显子,留下一个缩短但仍然有功能的基因。发现该疗法在小鼠中有效超过一年。
Exonics公司在多种小型和大型动物DMD临床前模型中,使用SingleCut CRISPR基因编辑技术,研究人员应用CRISPR靶向外显子51,使犬模型心肌中的dystrophin恢复至正常表达的92%。此外,该公司通过使用基于CRISPR-Cas9基因编辑技术的腺病毒(AAV)的有效载体在治疗DMD种发现,其能够识别和纠正那些阻止营养蛋白产生的外显子突变。其他研究团队也都先后证明: 以腺病毒为载体运载CRISPR-Cas9系统能精确敲除突变的外显子23,使mdx小鼠的肌萎缩蛋白功能得以重建。
关于各种不同的肌营养不良的治疗手段中,基因疗法已逐渐成为治疗该种疾病主流方法,其也在这种疾病中取得了可喜的治疗效果,然而不论是CRISPER还是其他基因治疗手段在该病上都存在一个最大的挑战,就是缺乏相应合适的病毒载体。因为与该病相关的基因组都比较大,比如,其中 DMD 的基因组,是目前已知的最大基因,其cDNA 长达14kb,大多数病毒基因载体难以运载,可以运载的效率也较低,因此,目前如果找到合适的病毒载体将会大大提高治疗肌营养不良的疗效。
该研究证明了CRISPR-dCas9介导的Lama1上调的可行性和治疗益处,这可能使所有MDC1A患者能够进行突变非依赖性治疗,该方法对其他疾病调节基因具有广泛的适用性,并且可以作为许多遗传性和获得性疾病的治疗策略。
此外,该种疗法作为一种组合治疗方法的应用,包括同时上调修饰基因和下调有害基因,这将成为减少疾病表型的新范例。
参考内容: https://www.nature.com/articles/s41586-019-1430-x https://www.fiercebiotech.com/research/treating-muscular-dystrophy-crispr-a-mutation-independent-manner