
面对干细胞治疗的很多不确定性,我们应当理性看待。尽管干细胞药物研发三期临床试验失败累累,但MSCs产品研发成果还是可圈可点。今天,我们就分析总结一下干细胞治疗成功的关键要素到底是什么。
众所周知,间充质基质细胞 (Mesenchymal Stromal Cells, MSCs)或间充质干细胞(Mesenchymal Stem Cells, MSCs)治疗是一种以调节炎症反应和参与组织修复再生特性为基础的细胞治疗。其机理也越来越清晰,MSCs的治疗作用主要归因于其在炎症环境调控下发挥的免疫调节功能。在炎症因子刺激下,MSCs产生大量免疫调节因子、细胞趋化因子和生长因子,调节组织免疫微环境和内源性成体干细胞,促进组织修复。
MSCs第一次用于人类疾病治疗开始于1995年,从恶性血液病患者抽取骨髓并分离培养出贴壁的基质细胞,然后回输到患者体内,观察临床效果并验证其安全性。这是MSCs研究史上的第一个里程碑式的事件,标志着MSCs的研究从实验室跨入到临床研究。
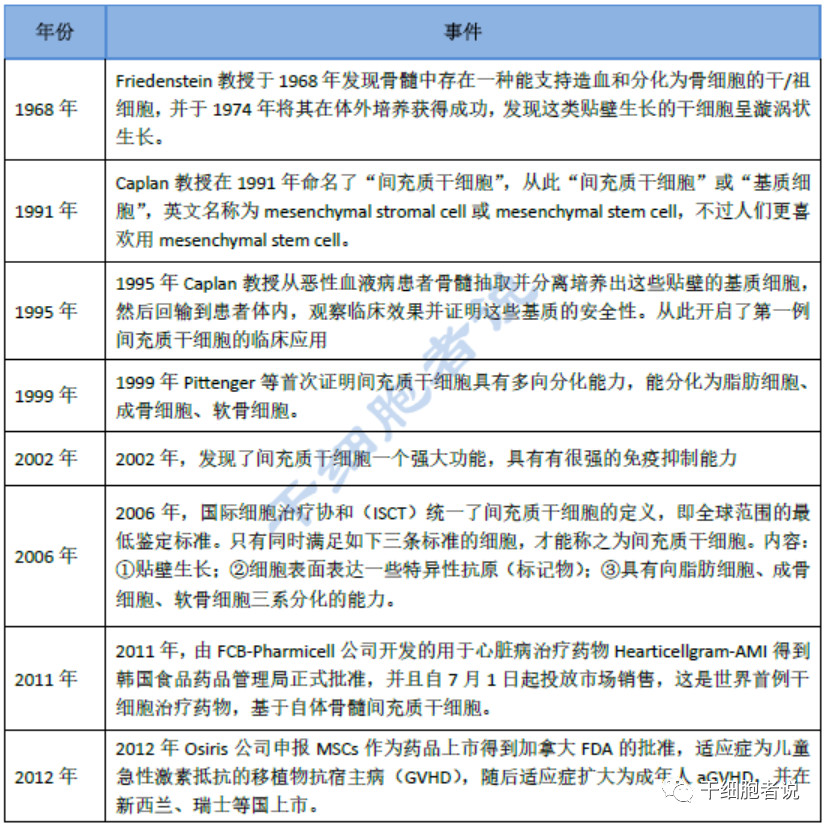 表1 MSCs研究发展历程
表1 MSCs研究发展历程
目前来看,MSCs已成为全球开展临床研究项目数最多的细胞,非常非常的热。然而迄今为止,这些细胞药物在美国尚未拥有允许上市许可的资格。全世界,特别是在美国,几乎所有的三期MSCs药物临床试验都是由药企资助或主导的。针对干细胞治疗的未熟先热,曾经有人批评这是一种干细胞行业的虚假繁荣。不仅仅中国存在干细胞乱象,美国,日本诸国都存在,这是个世界级现象。很多企业把未经证实的干细胞治疗(包括MSCs)作为“万能神药”进行过分吹嘘,宣称包治百病。
那么,干细胞临床治疗是否有效?如何才能有效?该用什么样的细胞?用多少量的细胞最佳?
尽管干细胞药物研发三期临床试验失败累累,但MSCs产品研发成果还是可圈可点。Cell Stem Cell的一篇综述道出了其中的大概缘由,以19项三期干细胞临床试验(由药企资助的)作为案例,分析总结干细胞治疗成功的关键要素。
本文主要通过以下三个案例分析:异体骨髓来源MSCs治疗移植物抗宿主病(GVHD)药物,自体骨髓来源MSCs治疗心脏衰竭(HF),以及异体脂肪来源MSCs治疗克罗恩病并发肛周瘘口。
第一个观点,我们以MSCs治疗GVHD为例。2012年,MSCs治疗儿童抗移植物抗宿主病(GVHD)药物(Prochymal)已经获得在加拿大和新西兰的有条件上市许可。随后,在日本也获得了批准(Temcell)。MSCs治疗GVHD是药企资助的第一个大型干细胞临床试验(Prochymal)(NCT00366145),并且已经于2009年5月完成,细胞是志愿者捐赠的骨髓间充质干细胞(BMSCs)。然而结果显示,在第一个有效评价点(即静脉回输后28天),相对于安慰剂组,干细胞治疗没有明显改善病症。
2013年,Prochymal产品从Osiris公司(美国)剥离给Mesoblast公司(澳大利亚)后。Mesoblast公司进行的临床试验有四项,包括儿童GVHD(NCT02336230)、克罗恩病(NCT00482092)、慢性心衰(NCT02032004)和慢性腰背痛(NCT02412735)。研究者在分析最初Prochymal治疗GVHD(NCT00366145)的数据发现,其总体的治疗效果是无效,其研究对象并没有针对性选择儿童还是成人。
随后,研究者通过大量在美国或欧洲的临床试验观察到。在治疗GVHD的临床试验过程中,儿童对异体MSCs治疗反应性要优于成年人;早期治疗的患者治疗效果要优于晚期治疗;肠道和肝脏的GVHD反应灵敏要优于皮肤的GVHD。在没有强有力可预测性生物标志物的情况下,这些意见用于提供临床试验设计,对适应症的选择具有重要的指导意义。
接下来在临床试验(NCT02336230)的适应症设计中,采用了相同的MSCs产品和剂量方案,但对患者选择更有针对性,这些因素包括年龄,疾病进程,以及排除只有皮肤的GVHD,进行干细胞治疗干预,并且都是异体骨髓来源MSCs解冻后输入。最重要的是,Mesoblast的这项临床试验研究对象是儿童,并且都使用冻存的细胞复苏后注入。2017年12月,临床试验(NCT02336230)完成了所有患者招募。
2018年2月,Mesoblast就通过媒体宣布,在治疗后28天,发现干细胞治疗难治性儿童GVHD相对于传统治疗对照45%的反应性,取得了显著改善(69%的反应性)。意味着,这款药物有望成为在美国第一款获得FDA批准上市的MSCs产品。
 表2.MSCs治疗GVHD,两项临床试验方案的对比
表2.MSCs治疗GVHD,两项临床试验方案的对比
最后补充一下,2019年5月,Mesoblast宣布已开始向美国FDA提交其MSCs药物Remestemcel-L (曾叫MSC-100-IV, 又叫Prochymal,授权日本销售那个叫Temcell,其实都是一回事)的上市申请(BLA),用于治疗类固醇难治性aGVHD患儿。
对早期临床试验结果的合理判断,会让后期选择参与临床试验的患者更能成功达到主要临床评价点。正所谓,“失之毫厘,谬以千里”。
由此可见,有时候并不是干细胞治疗无效,而是研究者选择错了或者是放宽了适应症。
第二个观点,我们再以MSCs治疗心脏衰竭为例。干细胞三期临床试验(NCT01768702)是Celyad(比利时)资助的一项自体骨髓间充质干细胞用于治疗慢性缺血性晚期心脏衰竭的临床试验。采用的细胞同样是骨髓间充质干细胞(BMSCs),与Prochymal产品的一个关键区别在于,Celyad对BMSCs进行“心脏修复”方面的表型强化,并且不经过冻存环节,将6X10*8个细胞通过介入的方法从心室将细胞直接给到病灶。
同样是Celyad资助的临床试验(NCT00810238),其临床结果表明使用了相同的MSCs产品可以改善心脏功能。然而,2016年的一项更为充分有力的临床试验(NCT01768702)表明在MSCs组和安慰剂组在39周时并没有显著差异。与以往研究不同,这些试验利用了自体BMSCs,减轻了免疫排异,使其功能达到最佳状态。但是,后来发现给药方式在该项治疗中极为关键。受试者接受6X10*8至12X10*8自体MSCs,重悬成10mL,分成18个位点注射,通过心室每个位点注射0.5ml干细胞,间隔1cm注射。如何实现生物学效应是技术上一个重要挑战。然而,该给药方式的缺点是给药方式技术难度大。对于低于8mm后的心室壁有穿孔的风险。
临床试验(NCT01768702)通过心室给药的受试者52周心肌重塑的结果显示,最大改善组是接收中等数量的注射次数(即,<20)。而更高的给药次数反而导致更糟糕的结果。有人担心注射都集中在良好的心肌区域,可能会增加组织的破坏和恶化结果的风险。 这种观察结果告诉我们,注射的次数可能是改善结果的一个重要因素,而过多的注射次数又可能导致通过多种机制,包括机械和生物性心肌损伤。
由此可见,有时候并不是干细胞治疗无效,有可能是给药方式的选择出现了问题。不恰当的给药方式可能会影响干细胞治疗效果。
第三个观点,我们以MSCs治疗肛周瘘口为例。同Celyad选择了自体骨髓MSCs一样,Cellerix公司资助的一项临床试验(NCT00475410),选择了自体脂肪间充质基质细胞(也叫脂肪基质/干细胞,adipose stromal cells,ASC)治疗肛周瘘口,将患者自体高达6000万个脂肪干细胞(加或不加纤维蛋白胶),在肛周瘘口多点局部注射,并用单独的纤维蛋白胶作为空白对照组比较。在2009年,总共214例受试者参与了该项研究,结果发现经脂肪干细胞处理组6个月后瘘的愈合效果并没有优于单独纤维蛋白胶组。
2011年5月,Cellerix被TiGenix公司收购,启动Cx601细胞药物三期临床试验(NCT01541579)。TiGenix公司就是比利时那个开发了细胞药物ChondroCelect(自体软骨细胞移植(ACI)),并且成功在欧洲上市的公司。适应症是:膝骨关节炎。根据NCT00475410获得的临床数据,由TiGenix赞助的三期临床试验将治疗方案做了如下改动:
1. 采用异体脂肪干细胞,而非自体脂肪干细胞
2. 细胞剂量从0.6亿增加至1.2亿个细胞,
3. 不再采用纤维蛋白胶基质胶做腔内注射;
4. 仅纳入克罗恩病患者(之前在试验NCT00475410中被排除)。
TiGenix赞助的临床试验(NCT01541579)在2015年已完成,也意味着MSCs/ASC在高级临床试验应用的成功。相关临床研究结果发表在2016年《The Lancet》,表明异体脂肪干细胞治疗是显著优于安慰剂。与安慰剂相比,24周后干细胞治疗组缓解率高于安慰剂(50%对34%)。治疗后,这些正向结果持续了至少1年。
 表3.MSCs治疗肛周瘘口,两个临床试验方案的对比
表3.MSCs治疗肛周瘘口,两个临床试验方案的对比
与先前的失败的临床试验不同,此次临床试验有三个很有意义的因素:合适的干细胞,给药途径和给药剂量。
其一,临床试验采用是正在培养中的细胞,而非解冻后直接注射。其二,采用1.2亿个细胞重悬24ml,直接病灶内注射,而非通过静脉回输的方式。最后,采用的是细胞库中同种异体来源的脂肪干细胞,而非自体脂肪干细胞。固然,节省成本是一回事。但这也使得临床前的动物模型试验更好摸索到合适的给药剂量,从而使MSCs产品发挥最大限度的生物学功能。
在2018年3月的时候,欧盟批准干细胞药物Alofisel(也就是Cx601),用于瘘管对至少一种传统或生物疗法反应不足的非活动性/轻度活动性管内克罗恩病(CD)成人患者复杂性肛周瘘口(CPF)的治疗。从而,Alofisel成为欧洲市场首个获得集中上市许可(MA)批准的异体干细胞疗法。
由此可见,有时候并不是干细胞治疗无效,有可能是细胞的选择或是给药剂量出现了问题。这同样会影响干细胞治疗效果。
这19项药企资助或主导的三期临床试验适应症包括:抗移植物宿主病、心脏衰竭、克罗恩病并发肛周瘘口、关节损伤、慢性脊髓损伤等。如果按组织来源分:14项是骨髓间充质干细胞(BMSCs),3项是脂肪间充质干细胞(ASC),2项是脐带间充质干细胞(UCMSC)。如果按照其细胞来源:11项是同种异体细胞治疗,8项是自体细胞治疗。如果按照给药方式:静脉回输、局部注射、与支架混合、局部介入治疗。
知其然,知其所以然。干细胞不是万能神药,干细胞治疗的有效性是建立在对干细胞和疾病正确认识的基础之上!干细胞药物开发和临床研究是一项空前复杂的系统工程,涉及到多学科、多技术、多因素综合考虑。其所面临的问题不单纯是细胞学家和医生就能够考虑周详的。关山难越,任重道远。我们既不要过早的宣布胜利,也不要过早的放弃一个有希望的治疗策略。
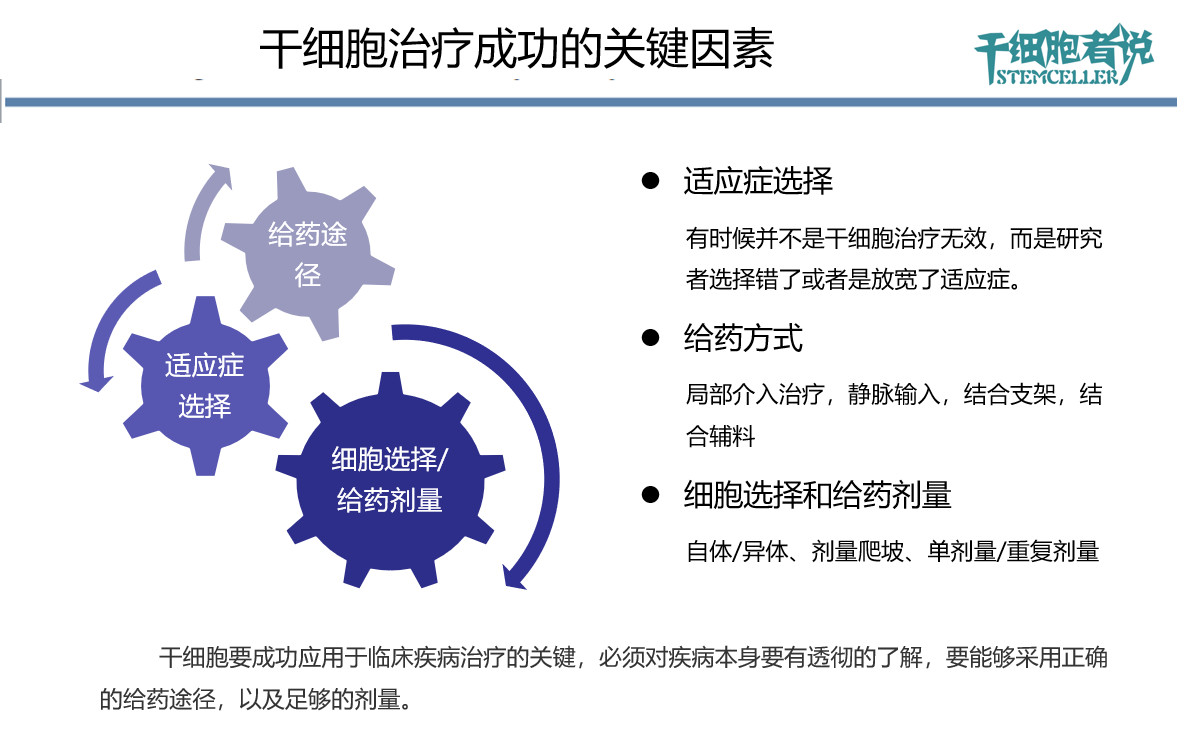
最后,我们以一张PPT总结本文:
 参考内容:
[1]Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell 22, 824–833 (2018)
参考内容:
[1]Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell 22, 824–833 (2018)