2023年第41届摩根大通医疗保健会议(JPM)正式恢复线下召开。
在第一天的报告出现了不少细胞与基因治疗的公司,有不少公司都带来了自己对2023年的积极展望,例如手握潜在首款DMD基因疗法的Serepta公司、首款治疗血友病A的获批基因疗法的BioMarin等;也有目前在监管问题中挣扎的一些公司:例如遭FDA临床暂停的Beam、裁员换血的Editas等。
bioSeedin将聚焦于Day 1 中的细胞与基因疗法部分,对其公开的报告进行整理与综合。
在周一上午的演讲中,诺华首席执行官Vas Narasimhan表示:公司的 2023 年战略侧重于五个治疗领域:心血管、免疫学、神经科学、实体瘤和血液学。
Narasimhan说,该公司计划在这些领域取得进展的方式之一是通过其基因治疗产品组合,并且表示诺华“内部有超过15个项目正在继续推进”。
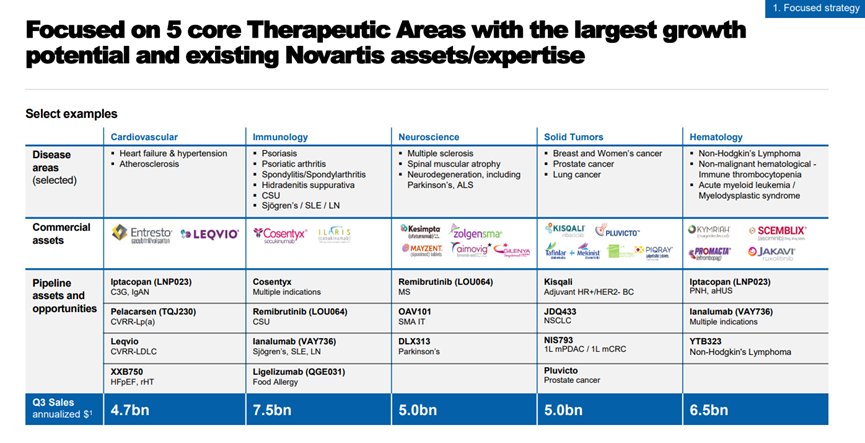
在免疫学方面,Narasimhan表示,诺华将使用其T-Charge平台将把大部分精力集中在细胞和基因治疗上。
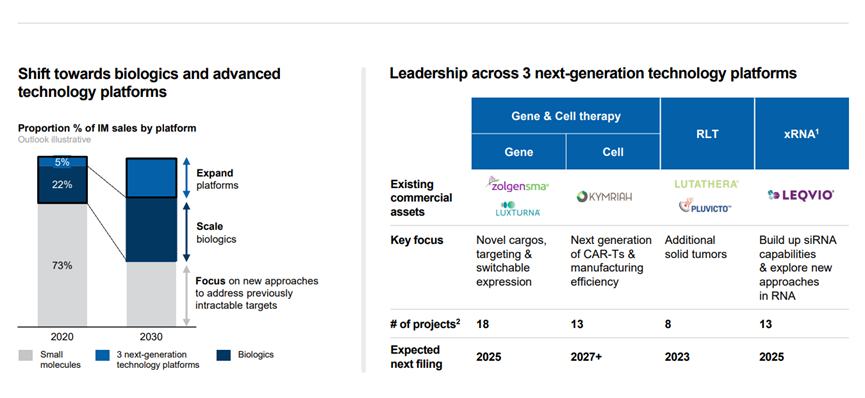
此外,诺华还特别指出了近期即将要公布临床试验读数的关键资产。

中午 12:12,Prime Medicine首席执行官Keith Gottesdiener在JPM23会议上发表演讲。Prime Medicine是刘如谦参与创立的第3家上市公司,专注于使用Prime Editing 技术进行基因编辑。

Keith提到近期基因疗法在FDA的屡屡碰壁,表示这些都是“成长的痛苦”,可能会在未来几年内得到解决。与此同时,他表示Prime公司拥有“强大的现金跑道”,暂时不担心资金问题。
Prime 有 18 个项目正在开发中,不过都处于非常早期的阶段。
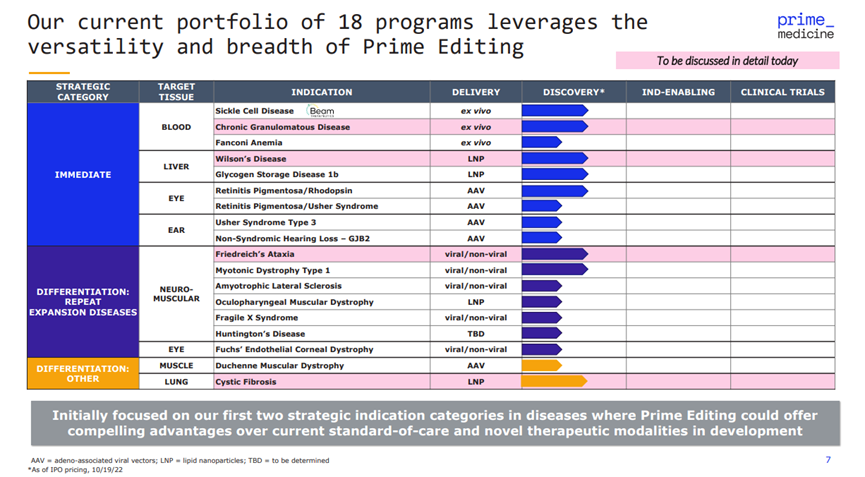
Keith表示,2023年,公司将着重寻找BD交易与外部合作的机会。
下午 12:51,BioMarin董事长兼首席执行官J.J. Bienaimé发表演讲,称其基因治疗产品Roctavian为迄今为止“最强劲的产品”。

Roctavian是一款治疗严重血友病A的基因疗法,使用AAV5病毒载体递送表达凝血因子VIII的转基因。今年8月24日,欧盟委员会(EC)批准此基因疗法有条件上市,成为首款用于治疗血友病A的基因疗法。
近日,BioMarin公司宣布了Roctavian取得3期临床的积极结果,该试验的随访时间超过了3年。这是目前规模最大,持续时间最长的血友病基因疗法全球3期临床试验。

试验结果显示,在治疗3年和4年的患者中,其凝血因子VIII的活性平均值分别为18.8和15.2,中位数值为8.4和7.4。两组的平均年出血事件率分别为1.0和0.8,而中位值都为0.0。此外,两组的年凝血因子平均使用次数分别为8.4和11.1,中位值也均为0。与基线值相比,在治疗的第三年后,患者的平均年出血事件率减少了80%,而凝血因子VIII的使用减少了94%。
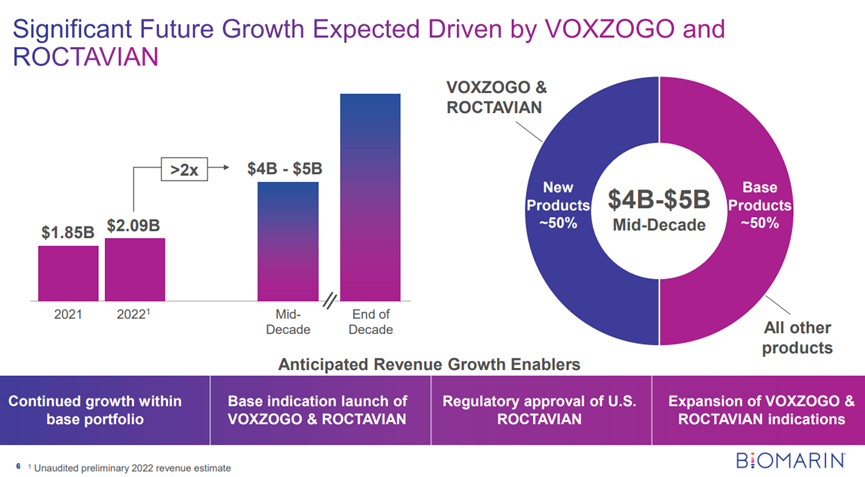
Bienaimé表示,他预计超过75%的美国处方者将在上市后一年内采用Roctavian来治疗严重的成人血友病A患者。加上Voxzogo,一种用于增加软骨发育不全儿童(5岁及以上)线性生长的疗法,Bienaimé预测到十年中期BioMarin的增长将达到40亿至50亿美元。
下午 1:30,Sarepta Therapeutics总裁兼首席执行官Doug Ingram发表报告。

11月,FDA接受了Sarepta 公司的BLA申请,如果获得批准,SRP-9001将成为市场上第一个针对杜氏肌营养不良(DMD)的基因疗法。FDA已将PDUFA日期定为2023年5月29日。
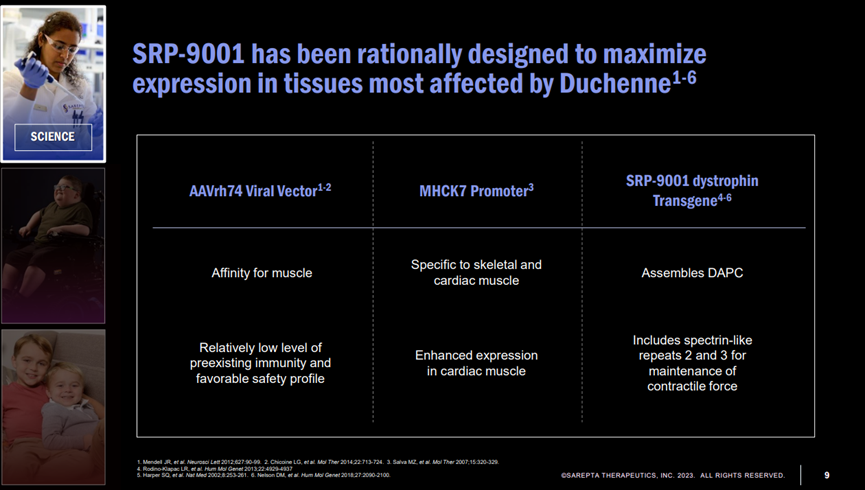
SRP-9001是通过AAV将编码微肌营养不良蛋白的基因传递到肌肉组织,使肌肉细胞表达对应的蛋白,从而减缓或阻止肌肉退化。
该疗法采用从非人灵长类动物中分离出的AAVrh74病毒载体,此病毒载体优点是能够在肌肉中引起转基因的强力表达,不会穿过血脑屏障进入中枢神经系统,且较少患者体内存在针对这一病毒载体的中和抗体。
Doug Ingram在大会上公布了相关数据,其中包括临床前动物模型,功能数据和生物标志物等,大量临床前和临床数据支持SRP-9001的疗效。

下午4:47,Beam Therapeutics公司发表演讲,该公司密切关注关注镰状细胞疗法的市场。

Beam 公司报告了公司血液学,免疫肿瘤学和遗传疾病产品组合的进展,并提供了预期即将到来的里程碑的最新情况。

第三季度财报中,Beam Therapeutics表示将停止对BEAM-102的IND申请进程。BEAM-102用于治疗镰状细胞病,通过直接编辑导致病变的血红蛋白S点突变来重建正常的人类血红蛋白。
今年7月,FDA暂停了其CAR-T 疗法BEAM-201的IND申请,后又得到解除。BEAM-201针对CD7靶点,是首个同时针对4个基因展开编辑的CAR-T疗法。
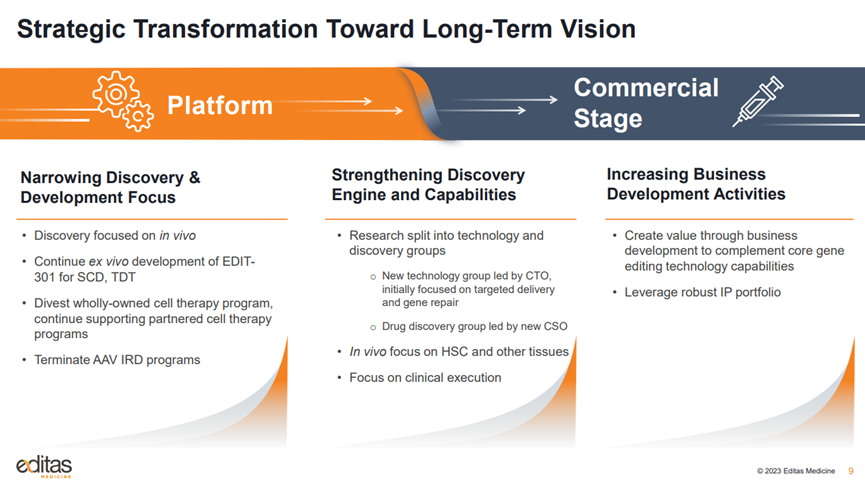
下基因编辑公司Editas Medicine在JPM宣布了重要战略更新,包括投资组合重新确定优先级和研发调整。该公司由张锋、刘如谦共同创立,于2016年上市,是全球CRISPR基因编辑领域首家IPO的公司。

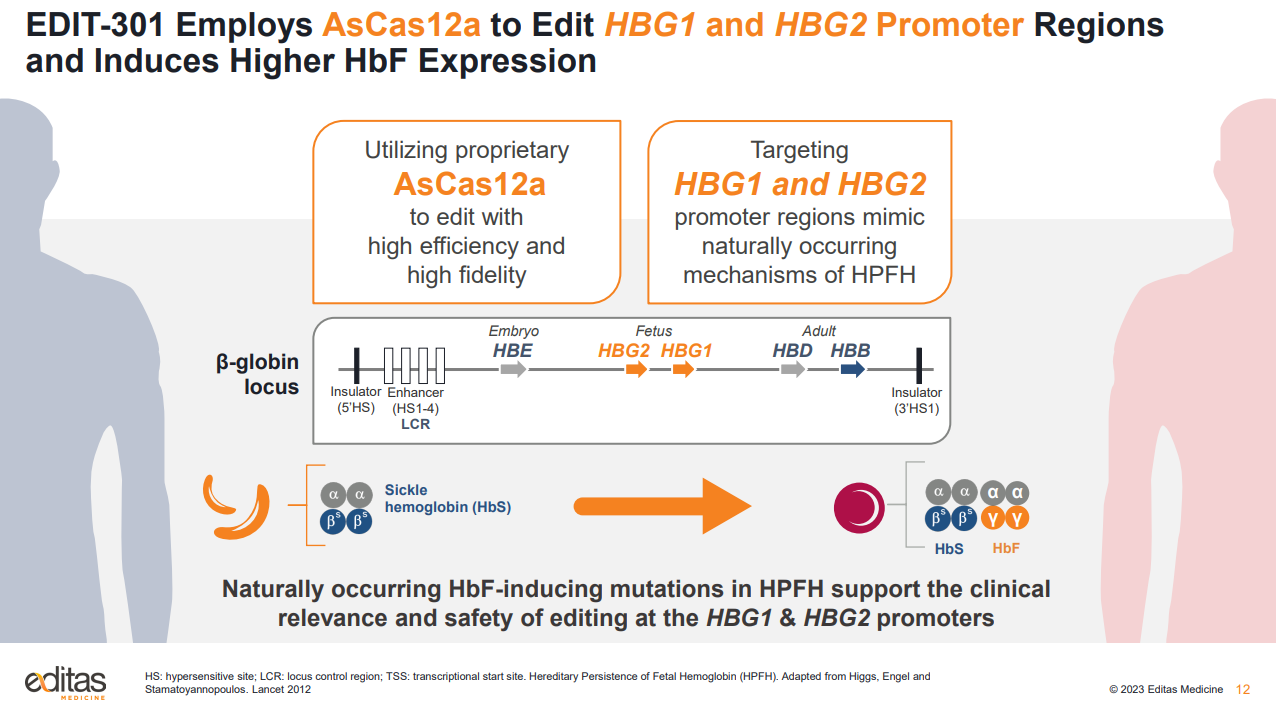
Editas表示,将停止对遗传性视网膜疾病和临床前全资拥有的iNK项目的内部投资,专注于血红蛋白病和体内基因编辑。公司将资源优先分配给EDIT-301,该项目用于治疗严重镰状细胞病和输血依赖性β地中海贫血。
Editas希望为遗传性眼病项目EDIT-101和EDIT-103寻找外部合作伙伴,但会继续开发合作研发的细胞疗法项目。
Editas裁员了20%,预计将把公司的现金跑道延长到2025年。此外,首席科学官Mark S. Shearman博士将从2023年3月31日起离开公司。