

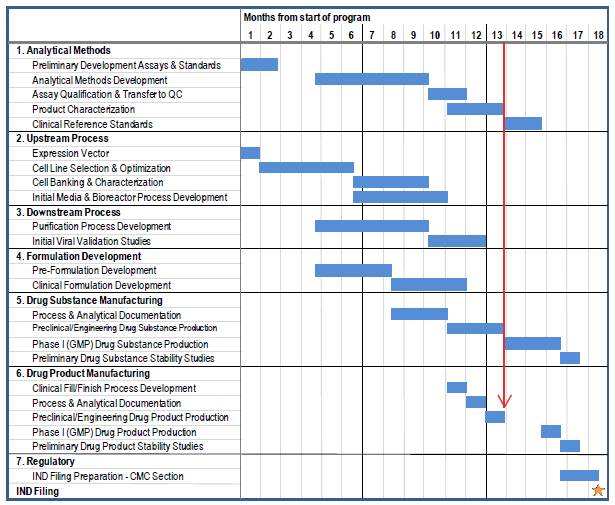
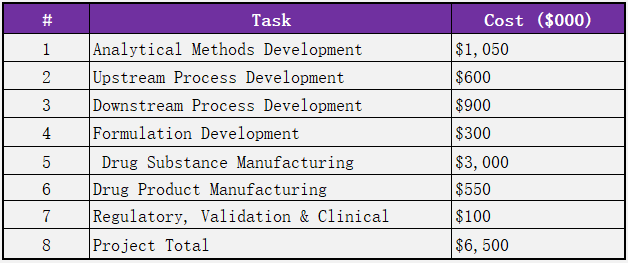
从第307问答中,可以看出整个IND申报中一共包含7个关键模块,其研发成本的初步估计如下表:
A:如下
♀ 生物药物的研发是一项十分复杂的活动,涉及到生物学、化学、药物、医学、工程、数理统计等多个学科的交叉,在开发过程中涉及到任何环节的微小遗漏,都有可能导致药物研发的失败,PM在生物药物开发项目扮演者重要的角色;
♀ Tineline的制定:PM应该根据企业的需求制定药物研发的Tineline,其制定应该考虑企业的实际情况,考虑各个研发模块在时间节点上的交叉与衔接,总体目标是降低企业研发成本、缩短研发时间、最终开发出能符合法规要求的药物生产工艺,提供药物质量符合要求的样品,用于临床试验的研究;
♀ 执行把控:PM在项目实际执行过程中也扮演重要的角色,包含对各个模块项目时间节点的把控、与各部门的沟通与协调、提供合理的问题解决方案等,都需要PM进行把关,这就要求PM需要具备扎实的专业基础、丰富的实战经验、强大的抗压能力等基本素质。
A:如下
♀ 药物研发的流程PM在制定药物研发Tineline时,应该重点考虑药物具备的三要素:安全性、有效性、可控性;
♀ 安全性:安全性是成药的前提,在药物开发的过程中,应该时刻关注生产工艺的变动对安全性的影响,任何影响药物安全性的工艺变动都应该足够重视,并应进行相应的风险评估和采取降低风险的措施;
♀ 有效性:在药物安全的基础上进一步评估药物的有效性,在药物开发的过程中,任何工艺优化和变动应该考虑是否影响药物的有效性,有效性是成药的关键,对于特定的疾病,安全无效的物质不具备药物的特征,所以不能成药;
♀ 可控性:药物除了具有安全有效的基础上,还必须具有对药物安全性和有效性进行控制的生产工艺,其控制主要基于工艺表征研究的结果,进行制定相应的设计空间、及操作空间,在任何设计空间内的工艺变更,不需要监管部门的批准,但需企业质量监管部门需要进行批准和备案;
♀ �