
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,达到治疗目的。基因治疗的爆发起源于20世纪90年代初,随着人类对基因治疗的认识不断加深,基因疗法也愈来愈成熟,经过三十几年科学技术的发展,全球的基因治疗行业已经大步迈向成长期,在某些适应证上基因治疗已经比传统的治疗方案更加有优势。
2019年5月,全球首个治疗输血依赖型β地中海贫血(TDT)的基因疗法Zynteglo(LentiGlobin,bb1111,含βA-T87Q珠蛋白编码基因的自体CD34+细胞)获得欧洲药品管理局(EMA)有条件批准,其研发公司为蓝鸟生物公司(bluebird bio)。Zynteglo是一种一次性基因疗法,开发用于治疗β 地中海贫血和镰状细胞病(SCD)。2020年9月,EMA已授予Zynteglo治疗SCD的优先药物资格(PRIME),此前,EMA还授予了Zynteglo治疗SCD的孤儿药资格(ODD);在美国,FDA授予了Zynteglo治疗SCD的ODD、快速通道资格(FTD)、再生医学先进疗法资格(RMAT)、罕见儿科疾病资格(RPDD)。
目前,LentiGlobin基因疗法用于治疗SCD正处于临床研究阶段,临床开发计划包括已完成的1/2期HGB-205研究、正在进行的1/2 期(HGB-206)和3期(HGB-210)临床研究。但这个适应症的开发过程就没有β 地中海贫血那么顺利,2021年2月16日,蓝鸟生物宣布停止基因疗法LentiGlobin治疗SCD的1/2期和3期临床研究,原因是参加其基因疗法LentiGlobin1/2 期(HGB-206)临床试验的SCD患者中分别出现一例患急性髓细胞白血病(AML)和一例骨髓细胞异常增生症(MDS)。2月23日,FDA发布公告称将蓝鸟公司治疗SCD的LentiGlobin基因治疗临床试验方案搁置。在经过FDA近一月的审查后,蓝鸟生物宣布,其LentiGlobin基因疗法是“极不可能(very unlikely)”导致接受治疗的镰状细胞病患者出现AML的,数据证明LentiGlobin基因疗法并不会使患者出现异常综合征,蓝鸟生物现在正与FDA谈判计划恢复临床试验。
无独有偶,在2020年8月时,FDA也拒绝过BioMarin的治疗A型血友病的基因疗法BMN270,因怀疑血友病患者接受基因治疗不能终身受益,要求BioMarin提供所有研究参与者的两年随访安全性和有效性数据;此后,不到半年的时间,UniQure的一项针对B型血友病的基因疗法也被美国FDA叫停,起因是一位志愿者患肝癌。针对这些问题,BioMarin 仍然希望其疗法获得批准;UniQure 认为癌症病例不太可能与治疗相关,临床试验也在继续进行中。
这一次的乌龙事件也只是让大家虚惊一场,基因治疗手段仍然被寄予厚望,Zynteglo的获批是一个好的开始,国内外药企对于血液疾病的基因治疗持续布局,下一个上市的基因治疗药物能否花落血液疾病领域,也让我们拭目以待。
血友病(Hemophilia)是一种X染色体连锁的隐性遗传性出血性疾病,可分为血友病A(血友病甲,缺乏凝血因子Ⅷ,患病人数约占80%~85%)、血友病B(血友病乙,缺乏凝血因子Ⅸ,患病人数约占15%~20%)和血友病C(血友病丙,缺乏凝血因子Ⅺ,罕见)。患者因凝血因子基因缺陷导致凝血功能障碍,终身具有轻微创伤后出血倾向,重症患者没有明显外伤也可发生“自发性”出血。血友病患者自出生时即可发病,伴随终身,如果得不到标准规范的治疗,致残及致死率很高。
目前临床上治疗血友病常规方案是替代治疗,即给患者补充所缺乏的凝血因子,但这种方案存在缺陷,如凝血因子在体内半衰期短,需反复注射等,不能治愈,需要终身治疗,但仍有出血风险,这不仅影响患者的正常生活,且治疗费用昂贵,给患者带来很大的经济负担。已上市的凝血因子代表产品如:Baxalta的Advate/Recombinate,诺和诺德的Novoseven,拜耳公司的KogenateFS等。Biogen的长效凝血因子Alprolix和Eloctate、拜耳的重组长效凝血因子 Kovaltry 也相继获批上市,长效凝血因子药物的市场和地位不断拓展和巩固。
近年来,市面上也出现了治疗血友病的创新药,如罗氏的Hemlibraâ(Emicizumab,艾美赛珠单抗)是血友病药物研发20年来首个获得FDA批准的用于治疗A型血友病的新药。根据2019年罗氏财报,Hemlibra年销售额达13.8亿瑞士法郎,增长超500%,Hemlibra需每周皮下注射一次,按照罗氏的定价,患者需要承担第一年48.2万美元、此后44.8万美元/年的用药成本。
基因疗法对血友病的治疗提供了“一劳永逸”的新思路,传统药物及像Hemlibra等新型抗体药物将直面基因疗法的冲击。早在1991年,我国科学家就进行了世界上首例血友病B的基因治疗临床试验。现阶段多个基因治疗临床试验已经表现出了良好的疗效与进展,如BioMarin公司的A型血友病基因疗法BMN 270已于近期提交了BLA申请,Sangamo/辉瑞的SB-525也处于III期临床阶段,血友病的用药市场格局即将被基因疗法所改变。
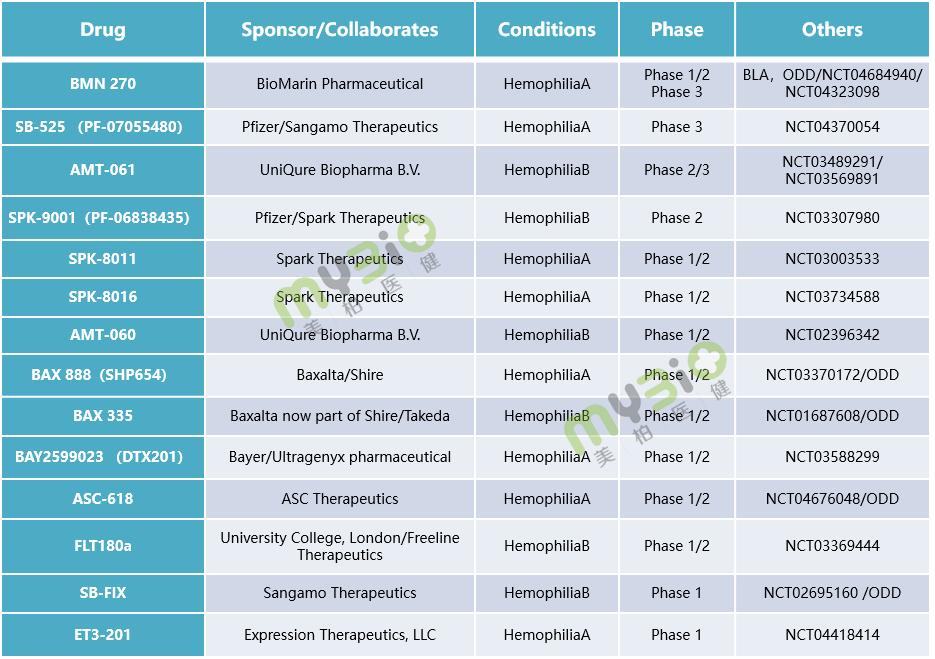
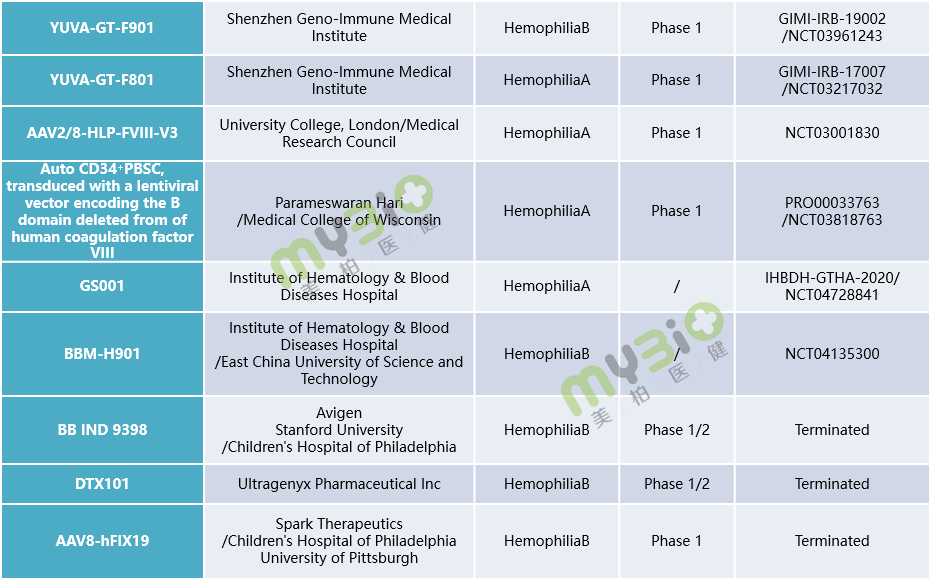 ▲表1 处于临床阶段的部分血友病基因治疗候选疗法
▲表1 处于临床阶段的部分血友病基因治疗候选疗法
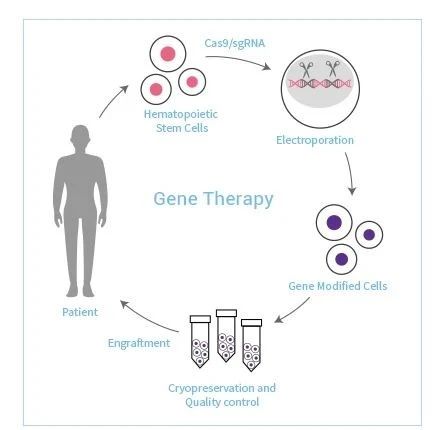
血友病基因治疗的主要模式为载体介导和细胞介导。载体介导即利用载体将目的基因转入靶细胞,使其在靶细胞中表达。细胞介导即提取患者细胞并利用ZFN、TALEN或CRISPR/Cas9等基因编辑技术进行基因改造,扩增后移植入患者体内。基因治疗可以使血友病患者体内自行表达FVIII或FIX,甚至可达正常水平,这使之成为“一次性”治愈血友病的唯一手段。
研发基因疗法用于治疗血友病的代表公司:
BioMarin创立于1996年,总部位于美国,是一家针对慢性基因性疾病研发的公司。
BioMarin的候选产品BMN 270正在进行3期临床试验,已经获得美国FDA授予的孤儿药和突破性疗法认定,也已获得而欧盟PRIME资格。其生物制品许可申请(BLA)已被FDA受理,优先审核用于治疗严重A型血友病患者,这是美国第一个针对血友病的基因治疗产品,也是有望成为第一个被批准用于治疗A型血友病患者的基因疗法。
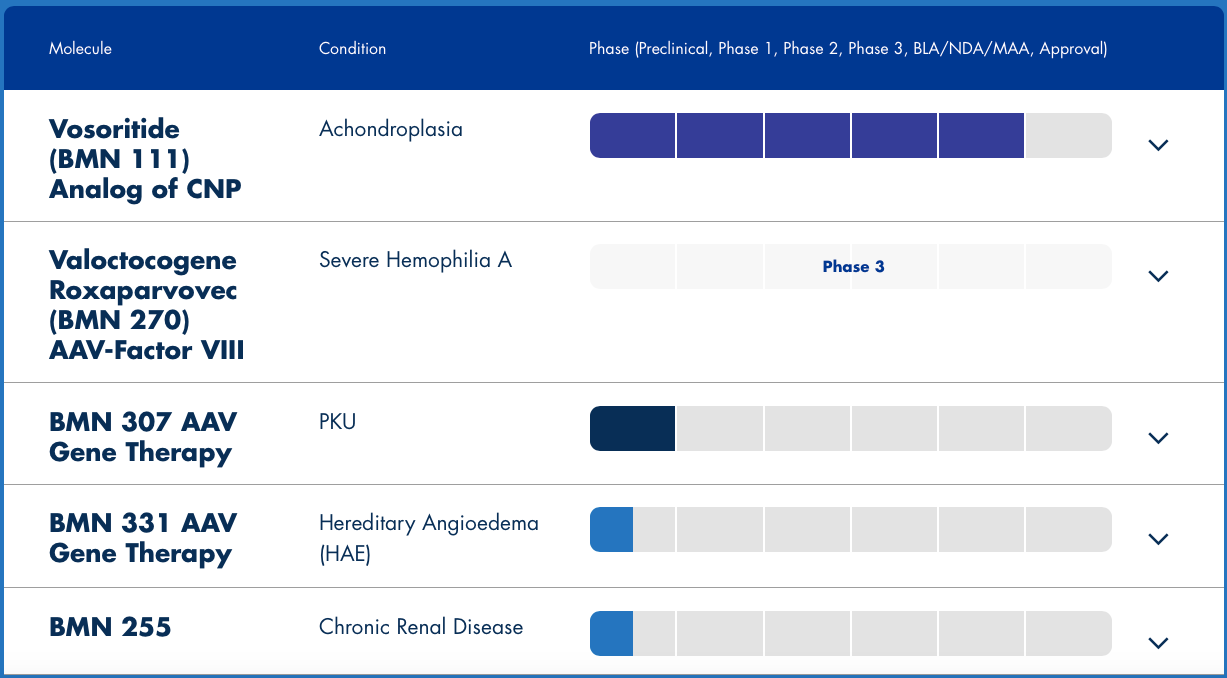 ▲图片来源:BioMarin官方网站
▲图片来源:BioMarin官方网站
Spark成立于2013年,总部位于宾夕法尼亚,是一家专注于遗传疾病基因治疗产品开发的公司,2019年12月,罗氏以48亿美金的价格完成对Spark的收购。
Spark最初是研究罕见病特效孤儿药的公司,2017年年底,其针对罕见眼科疾病的基因疗法Luxturna获FDA批准,成为首个在美国上市的基因疗法。其两款治疗血友病的明星产品SPK-9001和SPK-8011在临床上也表现出很好的疗效,此外,另一款基于AAV载体表达凝血因子VIII的基因疗法SPK-8016也处于临床阶段。
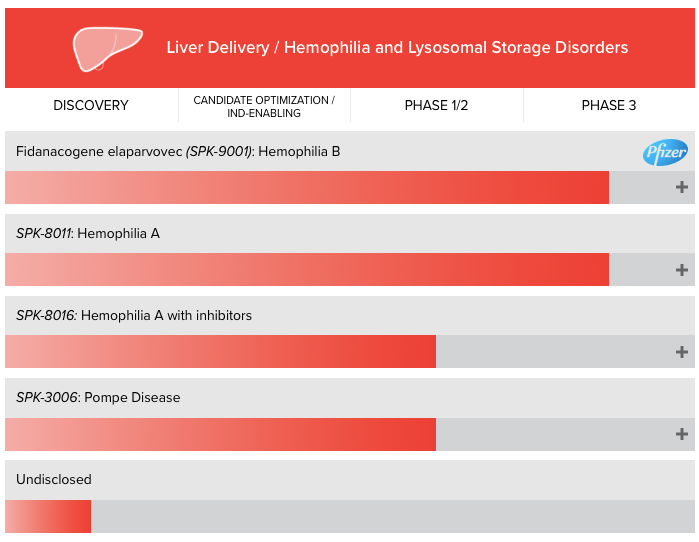 ▲图片来源:Spark官方网站
▲图片来源:Spark官方网站
UniQure创立于1998年,总部位于荷兰,是一家从事基因治疗药物开发的生物制药公司。UniQure拥有欧洲上市的首个基因疗法Glybera,用于治疗脂蛋白脂酶缺乏症(LPLD)。
2020年6月,UniQure宣布与CSL Behring签订许可协议, CSLBehring获得UniQure在B型血友病适应症上的的基因治疗产品AMT-061的全球独家权利,总交易额超20亿美元。
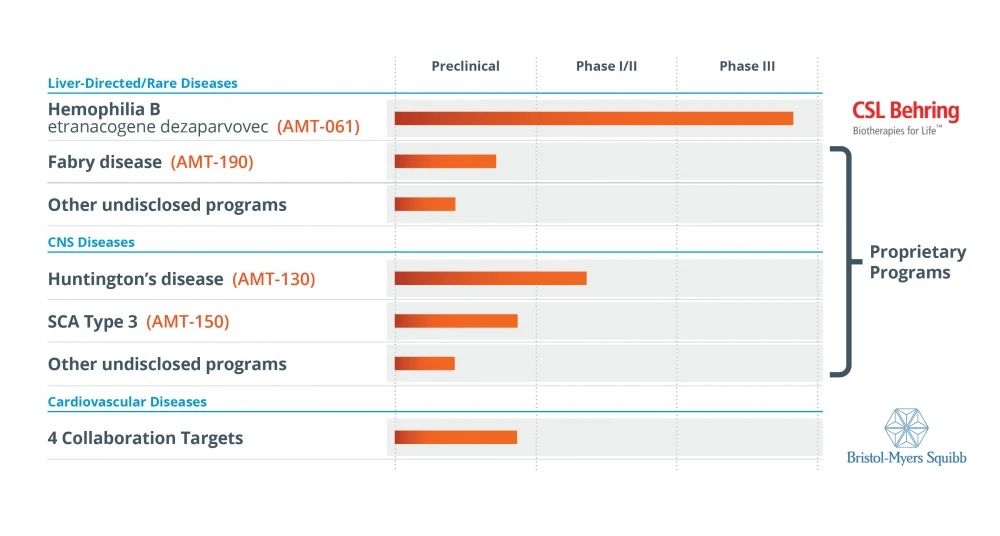 ▲图片来源:UniQure官方网站
▲图片来源:UniQure官方网站
Sangamo创立于1995年,总部位于美国,是一家专注于基因编辑、基因治疗和细胞治疗平台技术的生物制药公司。Sangamo在ZFN基因编辑技术上深耕20余年,ZFN技术相关的专利基本由该公司持有,获得包括锌指蛋白设计、筛选、优化、实验室及临床应用等多项专利。
2017年5月,Sangamo与Pfizer就一款A型血友病基因疗法SB-525,签署了全球独家合作和许可协议,交易金额达5.45亿美元。目前,FDA已授予SB-525孤儿药地位和快速通道认定。此外,2018年12月,Sangamo宣布1/2期临床试验评估SB-FIX的第一位患者进行治疗,这是全球首个利用锌指核酸酶(ZFN)技术并且针对B型血友病的在体基因编辑临床试验,且该疗法在2016年便获FDA授予的孤儿药资格。
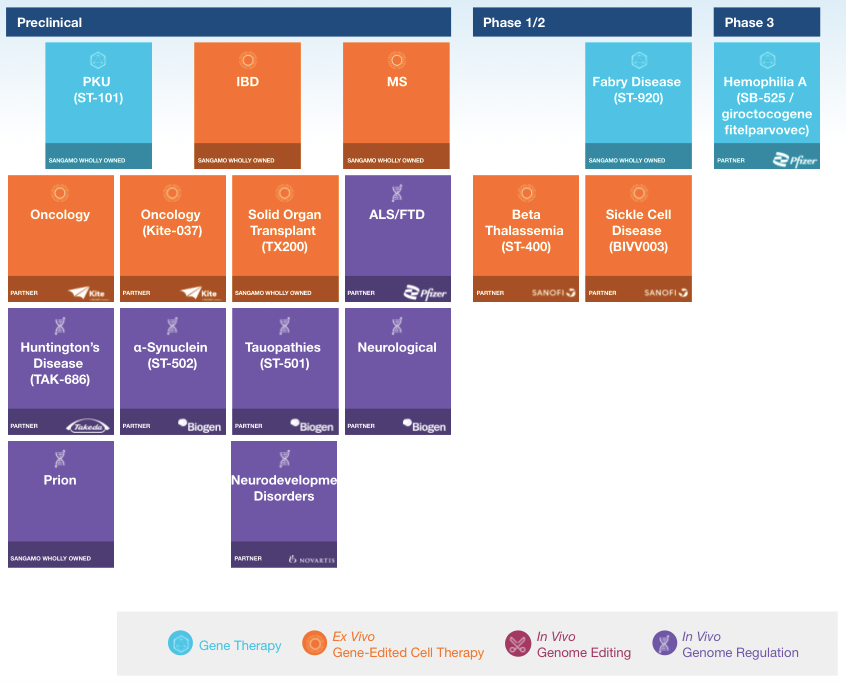 ▲图片来源:Sangamo官方网站
▲图片来源:Sangamo官方网站
ASC Therapeutics是一家快速发展的生物技术公司,通过其专有的基因编辑平台TARGATTTM和其他基因编辑技术开发治疗型产品,为尚珹投资在医疗领域的投资项目之一。
目前研发管线包括几个临床前阶段的项目,重点关注血液病的研究。根据clinicaltrials.gov显示,2021年4月,ASC Therapeutics公司将开展ASC-618治疗中重度血友病A的安全性及初步疗效评价临床研究。另外,管线上还有治疗A型血友病的基因疗法ASC-518、治疗B型血友病的基因疗法ASC-519及治疗β 地中海贫血的基因疗法ASC-520处于早期研究阶段。
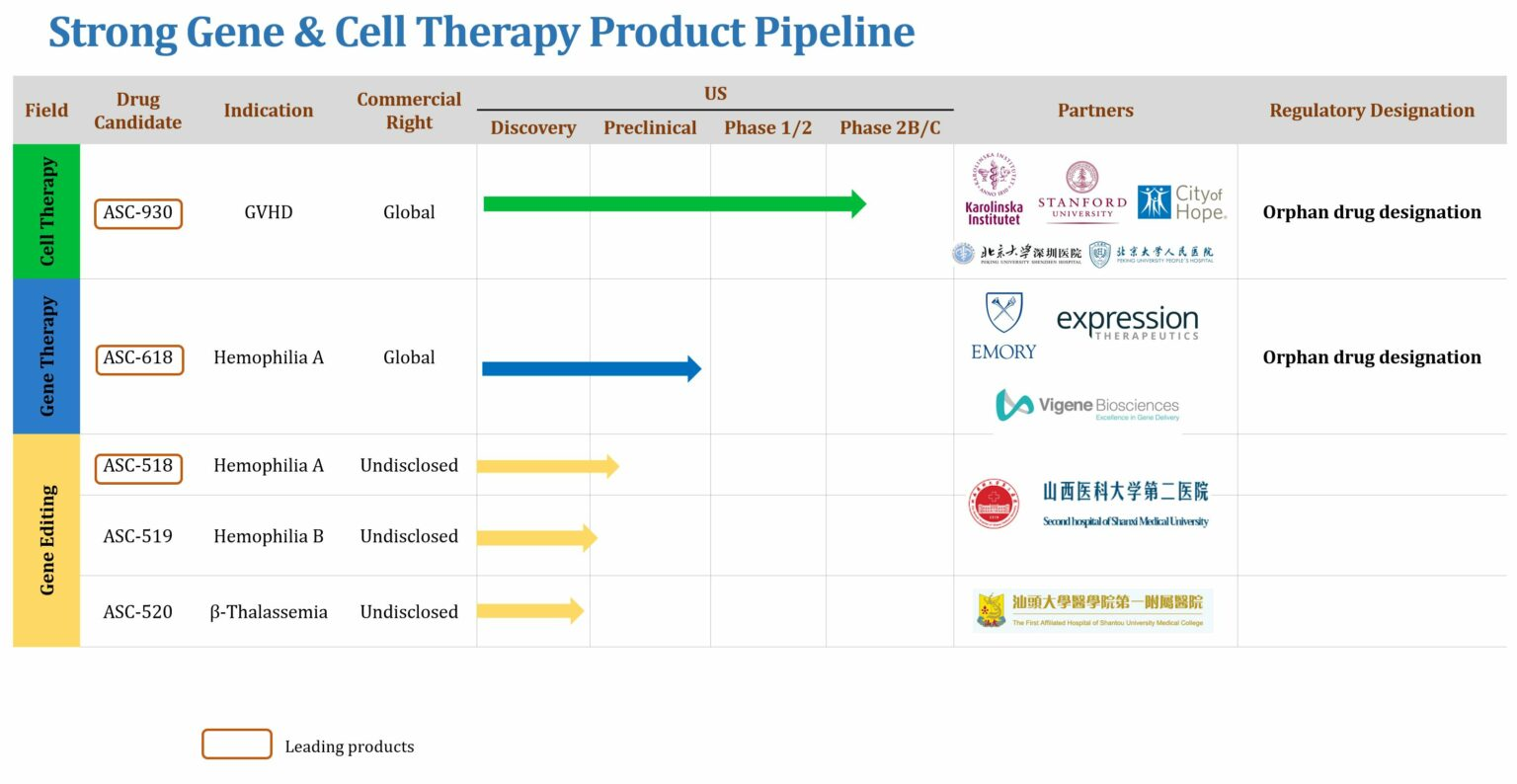 ▲图片来源:ASC Therapeutics官方网站
▲图片来源:ASC Therapeutics官方网站
Freeline创立于2015年,主要专注于利用基因疗法的潜力为患有慢性全身性疾病的病人提供治愈性治疗方法。Freeline开发了一种改进的AAV病毒衣壳,这种强大的衣壳在B型血友病患者的临床试验中得到验证。
2018年,Freeline完成1.16亿美元(约合人民币7.54亿元)的B轮融资,以推动其主打产品用于治疗B型血友病和法布里病的临床开发,以及其他产品管线的进展。同时新融资也将帮助Freeline进一步提高其基于AAV(腺相关病毒)衣壳的生产和进一步优化能力。
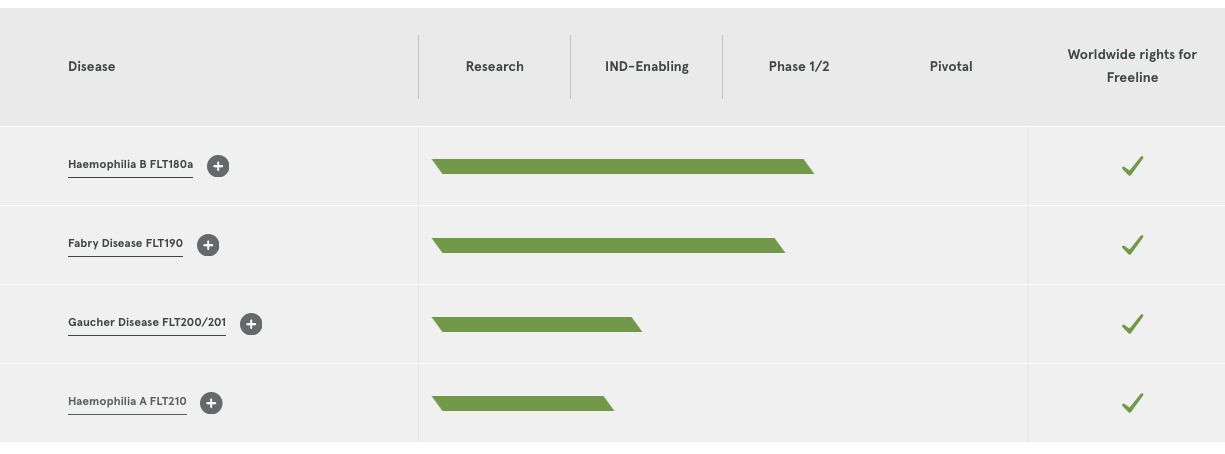 ▲图片来源:Freeline官方网站
▲图片来源:Freeline官方网站
Ultragenyx成立于2010年,总部位于加利福尼亚,是一家专注罕见病新药的研发和商业化的生物医药公司。
Ultragenyx与拜耳合作开发的用于治疗A型血友病的基因疗法BAY2599023 (DTX201)使用的是Regenxbio专有的NAV AAVhu37载体。DTX201最初是由Dimension研发,Ultragenyx于2017年11月完成对Dimension Therapeutics的收购,获得该产品。根据clinicaltrials.gov显示,拜耳于2018年11月启动BAY2599023(DTX201)关于成人严重血友病A的临床试验研究,这也是Bayer产品管线中唯一一款处于临床阶段的治疗血友病的基因疗法。
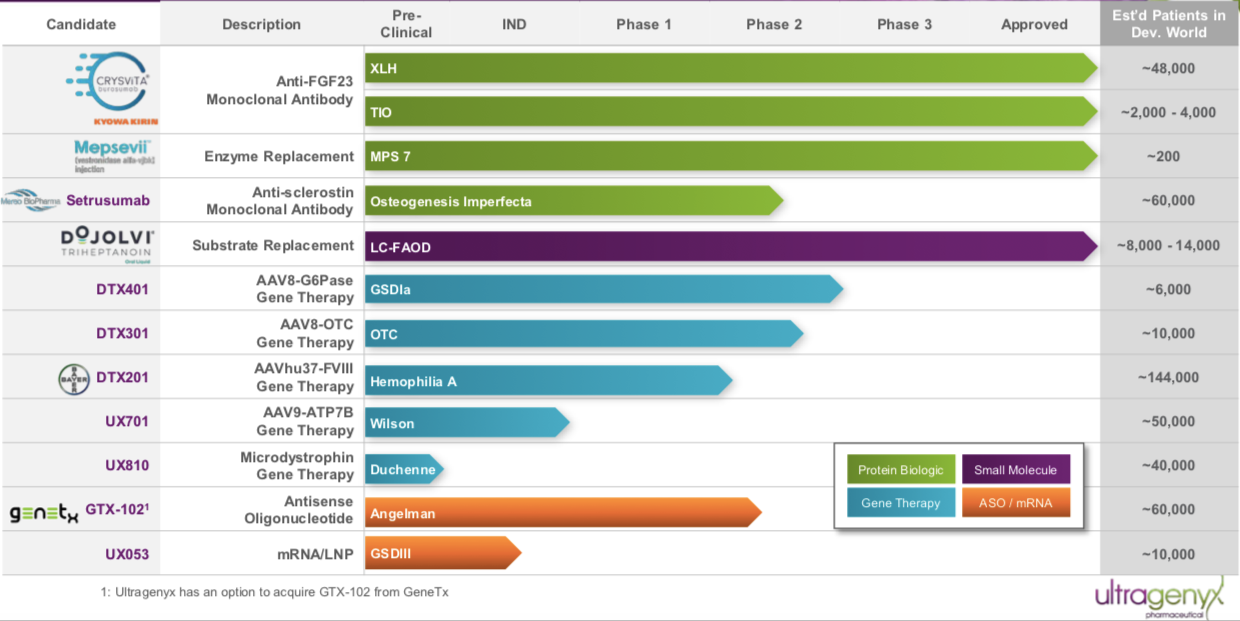 ▲图片来源:Ultragenyx官方网站
▲图片来源:Ultragenyx官方网站
另外值得一提的是基因治疗领域的新秀Regenxbio,Regenxbio致力于AAV(Adeno-associated virus,重组腺相关病毒)基因疗法的开发和商业化。Regenxbio拥有的NAV技术平台是一种专有的AAV基因递送平台,包括100多种新型AAV载体,比如AAV7、AAV8、AAV9和AAVrh10。
目前,Regenxbio已将NAV技术许可给10余家公司,并据此开发了超20个候选产品,主要用于治疗神经退行性疾病、血液疾病、视网膜疾病等适应症,合作方包括Novartis、Prevail、Pfizer、Takeda等企业。其中有2款治疗A型血友病的基因候选产品,目前分别由Takeda和Ultragenyx/Bayer进行后续开发。
 ▲图片来源:Regenxbio官方网站
▲图片来源:Regenxbio官方网站
Generation Bio创立于2016年,总部位于美国,是一家创新型基因药物公司,利用特有的非病毒基因治疗平台创建了一类新型的基因治疗产品。其创新点在递送系统,核心技术被称为non-viral closed-ended DNA(ceDNA),通过脂质纳米颗粒进入人体,这项技术能避开基于病毒的基因治疗中典型的免疫反应。Generation Bio自2018年来,先后完成三轮融资,并于2020年5月进行了IPO,同年6月于纳斯达克上市。
Generation Bio的产品线包括针对肝脏和视网膜的罕见病和流行疾病的八个项目,其中苯丙酮尿症(PKU)和A型血友病进展最快,处于临床前研究阶段。
 ▲图片来源:Generation Bio官方网站
▲图片来源:Generation Bio官方网站
深圳市免疫基因治疗研究院是经深圳市人民政府批准设立的具有独立法人资格的二类事业单位。研究院主要研究方向是针对癌症的CAR-T免疫细胞治疗及针对基因相关疾病的治疗。
深圳市免疫基因治疗研究院采用双重干细胞基因疗法治疗多项遗传疾病,对七种基因疾病进行深入研究,包括异染性脑白质营养不良、肾上腺脑白质营养不良、地中海贫血、血友病、视网膜眼睛疾病、X连锁严重联合免疫缺陷和范可尼贫血。
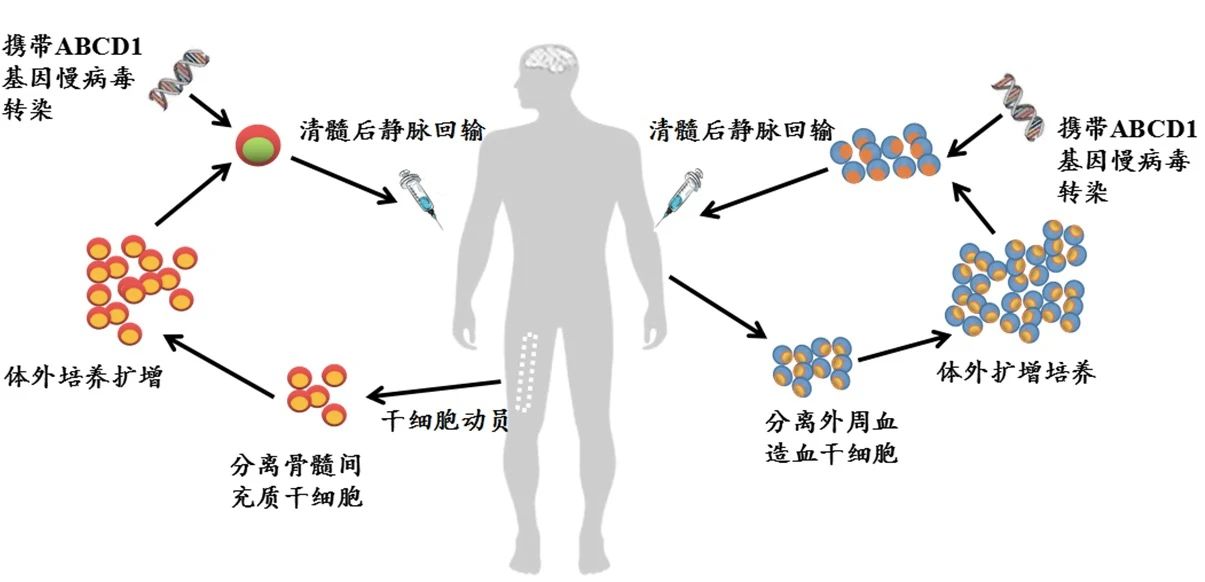 ▲图1 深圳市免疫基因治疗研究院拟采用的双重干细胞基因治疗示意图
▲图1 深圳市免疫基因治疗研究院拟采用的双重干细胞基因治疗示意图
虽然,我国在1991年就开展了首个针对血友病的基因治疗临床试验,但是直到近几年才有血友病基因疗法进一步开展临床阶段。中国医学科学院血液学研究所&血液病医院与华东理工大学共同申请的静脉输注基于AAV的基因疗法BBM-H901用于治疗血友病B临床试验(NCT04135300)于2019年10月发起,这也是国内首个AAV基因治疗临床试验。
深圳市免疫基因治疗研究院的YUVA-GT-F801、YUVA-GT-F901分别用于治疗A型血友病与B型血友病,目前也处于1期临床试验阶段。
此外,深圳市免疫基因治疗研究院还有关于地中海贫血、范可尼贫血的基因治疗试验也正开展临床。
五加和基因成立于2005年,技术团队从事病毒载体系统研究20余年,公司致力于为pre-IND和IND阶段基因药物提供符合GMP标准的病毒载体制品研发生产服务。
公司董事长兼总经理董小岩博士在2000年建立本元正阳基因技术股份有限公司基因治疗新药研发平台。2003年,其自主研发使用AAV载体的血友病B基因药物研发项目AAV2-hFIX获批,系中国首个被批准的血友病B基因治疗药物临床方案。2005年创建北京五加和,带领团队研发用于治疗B型血友病、A型血友病、SMA、DMD、ALS、遗传性高脂血症、青光眼等26种疾病的基因药物。
至善唯新成立于2018年,是一家专注rAAV基因药物研发与颠覆式生产的国内基因治疗领军企业。公司拥有基因疗法领域的专业团队,创始人董飚从事rAAV病毒载体研究超过十年,在基因疗法药物设计与规模化生产方面均取得了突破性进展,治疗领域涵盖血液疾病、罕见病等多个疾病领域。
至善唯新拥有全球领先的新型rAAV生产系统,针对A型血友病和B型血友病都有了相应的rAAV基因药物临床管线布局,已经完成临床前的动物模型验证。其中,针对B型血友病的临床管线是公司眼下重点推进的项目,利用有自主专利的规模化载体生产技术和高效IX因子,开发治疗B型血友病的rAAV药物,该项目将于2021年提交临床批件注册申报。除布局血友病方向的管线外,至善唯新利用自身在于rAAV基因治疗领域储备的技术优势,在抗衰老和神经退行性疾病方向也有相应的管线布局,包括针对帕金森症、老年痴呆症的rAAV基因药物研究等。
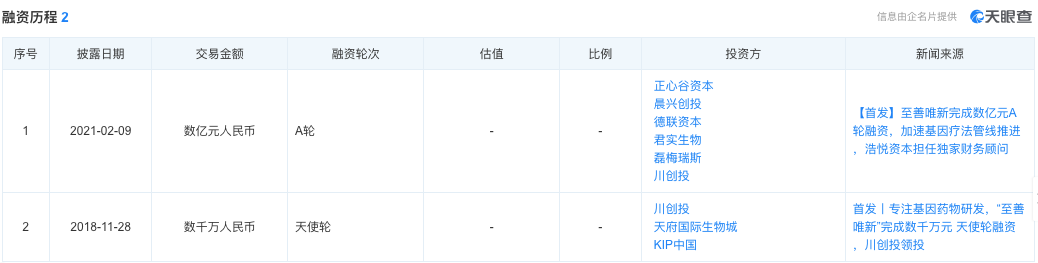 ▲图片来源:天眼查官方网站
▲图片来源:天眼查官方网站
至善唯新成立不足半年,便获得由川创投领投的数千万人民币天使轮融资;2021年2月,又完成了数亿元人民币的A轮融资,用来加速基因疗法管线的推进,其中,君实生物持有至善唯新约6.6%的股权。
信念医药成立于2018年,致力于基因治疗药物的产业化研发和临床应用,包括腺相关病毒基因治疗载体的前端筛选、生产工艺优化、GMP生产、临床质控标准和临床试验等。信念医药计划从生物科技公司逐步转型为生物医药公司,目前已完成数千万的天使轮与数亿元的 A 轮融资。
信念的产品布局主要专注在开发以AAV为载体的基因疗法,产品线包括血友病 A、血友病 B、帕金森症、老年黄斑变性、粘多糖贮积症、肌萎缩侧索硬化症、遗传性血管水肿、嗜血细胞综合征、法布里疾病等适应症,其中研发最快的两个产品就是血友病B和血友病A。
华东理工大学与血液所申报的血友病基因治疗产品BBM-H901正是出自信念医药的子公司上海信致医药科技有限公司临床药物生产场地,位于华东理工大学国家大学科技园梅陇基地内。
此外,国际上还有很多公司正在积极布局血友病基因治疗产品,如诺和诺德与蓝鸟生物于2019年10月达成合作协议,双方合作重点利用蓝鸟生物的megaTAL技术开发A型血友病的基因疗法;再生元与Intellia Therapeutics扩大双方自2016年的合作,交易额达1亿美元,双方合作重点是开发治疗A型血友病和B型血友病的潜在CRISPR / Cas9编辑基因治疗候选药物;赛诺菲与合作已久的慢病毒载体开发商Oxford BioMedica(OXB)利用其开发和生产用于治疗血友病的慢病毒载体,首次开发基于慢病毒的体内给药血友病基因疗法等。
基因疗法用于β地中海贫血
地中海贫血(Thalassemia,地贫)即珠蛋白生成障碍性贫血,是一组常染色体遗传的溶血性贫血疾病,其致病机制是珠蛋白基因缺陷使血红蛋白中的珠蛋白肽链有一种或几种合成减少或不能合成,导致血红蛋白的组成成分改变,进而引发红细胞寿命缩短,表现为慢性溶血性贫血。根据珠蛋白链缺乏种类不同,地中海贫血分为α型、β型、δβ型、δ型和ebgδ型,其中临床上以β和α型地贫最为常见,α-地贫又分静止型、轻型、中间性和重型;β-地贫又分轻型、中间型和重型。
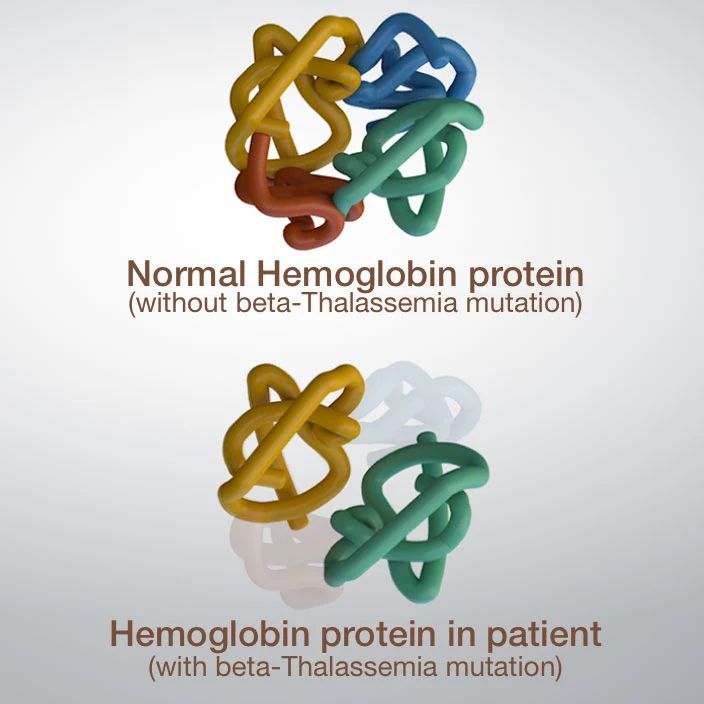 ▲图2 β-地贫致病机制示意图
▲图2 β-地贫致病机制示意图
目前,针对β-地贫的疗法有输血替代治疗、脾脏切除和造血干细胞移植治疗等。其中定期输血是临床上比较常规的治疗方案,患者需要终身治疗,治疗费用昂贵且易产生输血副反应,还须同时接受去铁治疗,但去铁治疗也同样会伴随严重不良反应,常用铁螯合剂包括得斯芬、奥贝安可、恩瑞格等;对于经正常输血治疗及去铁治疗后铁负荷仍增加的患者考虑脾脏切除,但此治疗方案会增加严重败血症发生的风险,且对重症β-地贫患者效果仍差强人意;造血干细胞移植治疗是目前能够根治的唯一方案,可通过骨髓移植、外周血干细胞移植、脐血移植等方案将健康人的造血干细胞移植至病人体内,但配型十分困难,且供体来源有限,即使配型成功仍需长期服用免疫抑制药物,治疗费用也十分昂贵。
在β 地中海贫血(TDT)治疗领域,也有一些新药获批,BMS的Reblozyl就是第一个获FDA批准治疗β 地中海贫血相关贫血的药物,同时也是十多年来第一个获FDA批准用于需要输注红细胞(RBC)且接受一种红细胞生成刺激剂治疗失败的骨髓增生异常综合症(MDS)患者的新治疗方案。特别值得注意的是,在需要立即纠正贫血的患者中,Reblozyl不适用于作为红细胞输注的替代品。此前,华尔街投行Jefferies分析师预测,Reblozyl获FDA批准后的年销售峰值将达到20亿美元。
基因疗法为β地中海贫血提供了新的治疗思路,将造血干细胞从病人自身的外周血中收集后,通过病毒载体导入正常的珠蛋白基因以使细胞功能恢复正常,再将改造后的造血干细胞回输给病人。这种治疗方案的优势在于,供体来源不需要通过捐赠、异体移植,解决了干细胞来源不足以及配型困难等问题,一次治疗就可能满足永久性的“治愈”,有望取代目前并不完美的治疗方案。
2019年5月,全球首个治疗输血依赖型β地中海贫血的基因疗法Zynteglo获得欧洲药品管理局(EMA)有条件批准,也有多家企业正在进行β 地中海贫血基因疗法的临床及临床前的实验研究。
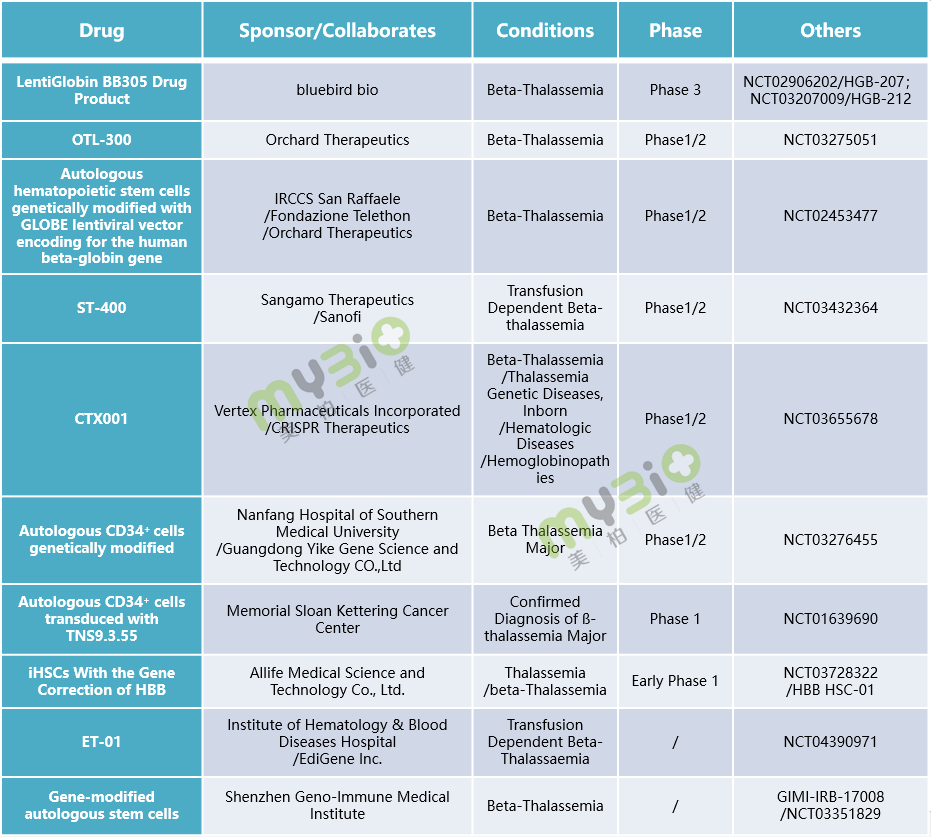 ▲表2 处于临床阶段的部分β 地中海贫血基因治疗候选疗法
▲表2 处于临床阶段的部分β 地中海贫血基因治疗候选疗法这种一次性的基因治疗方法,可直接解决β地中海贫血的内在基因病因,有潜力使患者摆脱输血依赖(输血非依赖),一旦成功,患者将终身受益。
研发基因疗法用于治疗β地中海贫血的代表公司:
蓝鸟生物公司(bluebird bio)创立于1992年,总部位于美国,原名Genetix Pharmaceuticals, Inc.,于2010年9月改为bluebird bio,是一家致力于为治疗严重的遗传疾病和罕见疾病开发革命性基因疗法的临床阶段生物技术公司。
蓝鸟生物的基因产品LentiGlobin治疗β 地中海贫血已获EMA批准,这是针对β-地中海贫血的首款基因疗法,LentiGlobin的另一适应症SCD正处于临床研究阶段。
 ▲图片来源:bluebird bio官方网站
▲图片来源:bluebird bio官方网站
Orchard成立于2015年,位于英国,是一家致力于为患有严重和危及生命的孤儿疾病的患者提供变革性基因治疗的公司,将利用离体自体造血干细胞基因治疗的潜力来恢复正常的基因功能。
OTL-300是一种实验性自体体外慢病毒基因疗法,2018年4月,Orchard从葛兰素史克收购该基因疗法,EMA已授予OTL-300治疗TDT的优先药物资格。继收购GSK基因疗法后,Orchard获1.5亿美元C轮融资,随后IPO上市。
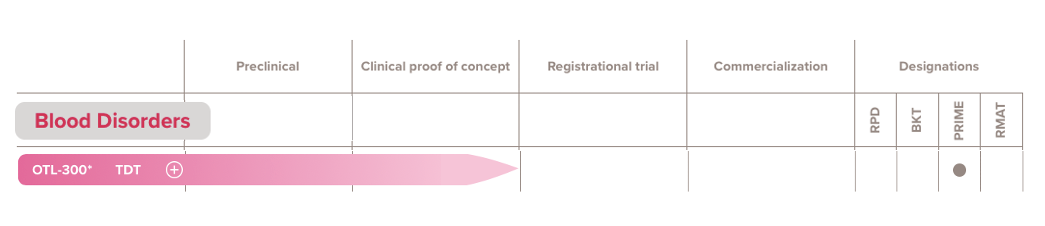 ▲图片来源:Orchard官方网站
▲图片来源:Orchard官方网站
CRISPR Therapeutics于2013年10月成立于瑞士,研究中心在马萨诸塞州剑桥,由获得2020年诺贝尔化学奖的Emmanuelle Charpentier及其同事创立,致力于利用其专利 CRISPR/Cas9 基因编辑平台开发革命性药物。Vertex成立于1989年,是一家致力于开发治疗严重疾病药物的生物技术公司,囊性纤维化治疗领域的全球领导者,目前已上市多款囊性纤维化疗法。CRISPR Therapeutics与Vertex也建立了战略合作伙伴关系,开发基于CRISPR技术的基因治疗方案。
2015年,CRISPR与Vertex达成合作,双方协议利用CRISPR/Cas9 基因编辑技术去发现和开发针对人类疾病内在基因原因的潜在新疗法,CTX001就是利用这项合作的首个成果。2018年,CTX001获得了美国和欧洲监管机构的新药研究申请批件,这也是全球首个由制药公司发起的体外CRISPR疗法的新药临床试验。目前,CTX001处于I/II期临床试验阶段,获得了FDA 授予的再生医学高级疗法(RMAT)、快速审评通道、孤儿药和罕见儿科疾病药物称号,还获得EMA授予的针对镰状细胞病和 β 地中海贫血的孤儿药称号以及针对镰状细胞病的优先审评药物资格。
 ▲图片来源:CRISPR官方网站
▲图片来源:CRISPR官方网站
由CRISPR领域的领军人物张锋和Jennifer Doudna共同创建的Editas成立于2013年,是最早上市的CRISPR-Cas9技术公司。
公司的研发管线中治疗伯氏先天性黑蒙症的EDIT-101疗法进展最快,已经进入临床阶段,其次是EDIT-301疗法,用于镰状细胞病与β 地中海贫血。
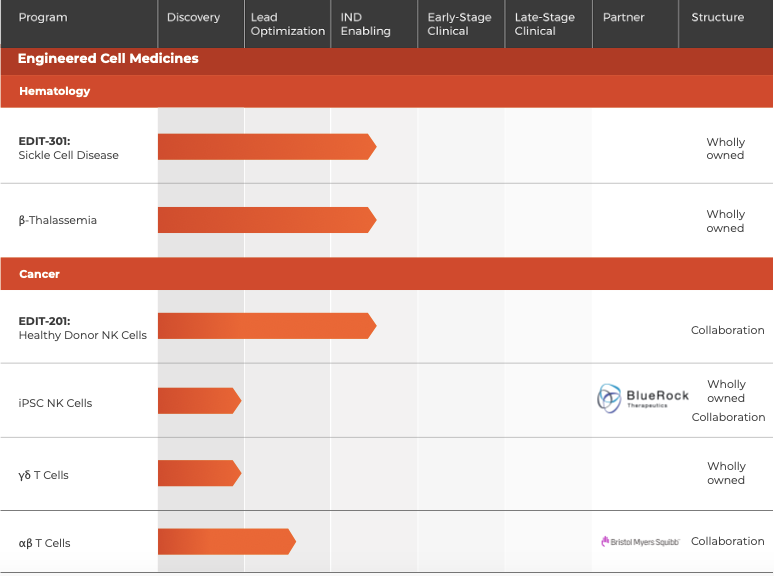 ▲图片来源:Editas官方网站
▲图片来源:Editas官方网站
上文提到,Sangamo与Pfizer合作开发A型血友病基因疗法SB-525,Sangamo还与Sanofi合作将ZFN基因编辑技术应用于输血依赖性β-地中海贫血的治疗,其相关产品ST-400处于1/2期临床试验阶段。
近年来,Sanofi不断布局基因疗法领域。自2018年1月完成收购专注于血友病的Bioverativ公司后,Sanofi也公布了许多基因疗法相关的积极消息,除与Sangamo合作开发ST-400外,双方还共同研究治疗镰状细胞病的基因疗法BIVV003;2019年,Sanofi首个基于AAV的基因疗法进入临床,用于治疗由常染色体隐性鸟苷酸环化酶2D(GUCY2D)突变引起的Leber先天性黑朦(LCA)的罕见眼科疾病;2021年2月,Sanofi与Sirion也达成合作,双方共同开发基于病毒载体的基因传递技术。
博雅辑因成立于2015年,是一家致力于通过国际前沿的基因组编辑技术,为多种遗传疾病和癌症加速药物研究以及开发创新疗法的生物医药企业。博雅辑因有造血干细胞平台、通用型CAR-T平台、体内疗法-RNA碱基编辑平台、高通量基因组编辑筛选-新药研发平台四大平台。其中,造血干细胞平台通过基因编辑自体造血干细胞,针对β地中海贫血病和其他贫血病的创新疗法。
博雅辑因利用四大技术平台已经开发了十余条产品管线,其中进展最快的是一种体外基因疗法,针对输血依赖型β地中海贫血的ET-01和针对癌症的异体CAR-T ET-02。ET-01基于CRISPR的基因编辑疗法,通过提高患者胎儿血红蛋白水平弥补正常β血红蛋白的不足。临床前研究证明了该方法的可行性。2020年10月,中国国家药品监督管理局受理了我国首个CRISPR基因编辑疗法临床试验申请。
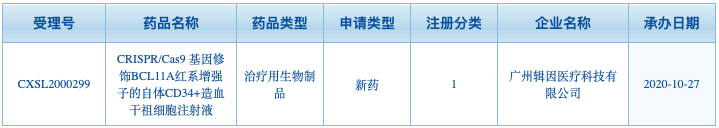 ▲图片来自:国家药品监督管理局药品审评中心官网
▲图片来自:国家药品监督管理局药品审评中心官网
博雅辑因的ET-01项目也受到国际上的认可,2019年,在第61届美国血液学年会(ASH)上,博雅辑因发布了其β地中海贫血基因编辑治疗项目的规模化生产及临床前安全性和有效性试验数据。
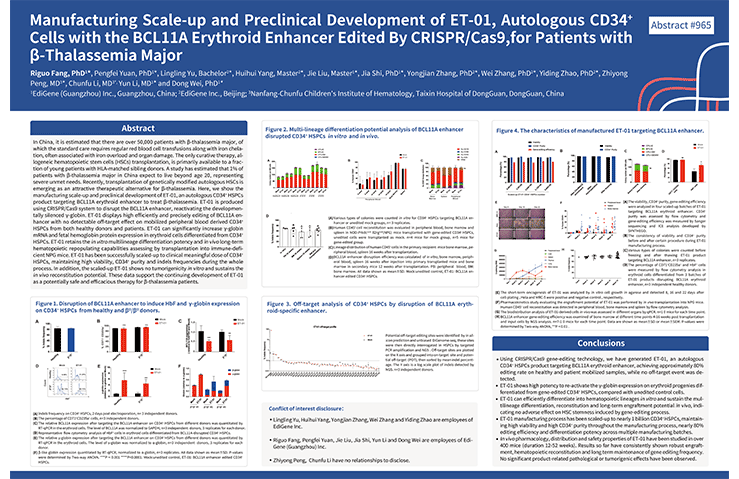 ▲图片来自:博雅辑因官方网站
▲图片来自:博雅辑因官方网站
呈诺医学(Allife Medical Science and Technology Co., Ltd.)创立于2017年,由中英两国科学家创办。公司立足于自主研发的iPSC诱导多能干细胞技术平台,致力于开发国际前沿的创新型功能细胞治疗药物。
呈诺医学拥有成熟的诱导多能干细胞(iPSC)制备技术,以此为基础研发了针对罕见病、帕金森、糖尿病和心血管疾病的治疗产品,现阶段将侧重于法布雷(Fabry)和渐冻症(ALS),这两种罕见病在中国有十几万患者需要治疗。另外,呈诺医学的肿瘤免疫细胞产品以自然杀伤细胞(NK)为基础,从技术角度看,CAR-NK疗法安全性更好,且易获得,易操控,免疫原性较低;从临床结果看, CAR-NK对癌细胞的杀伤效果同CAR-T疗法也不相上下。
 ▲图片来源:呈诺医学官方网站
▲图片来源:呈诺医学官方网站
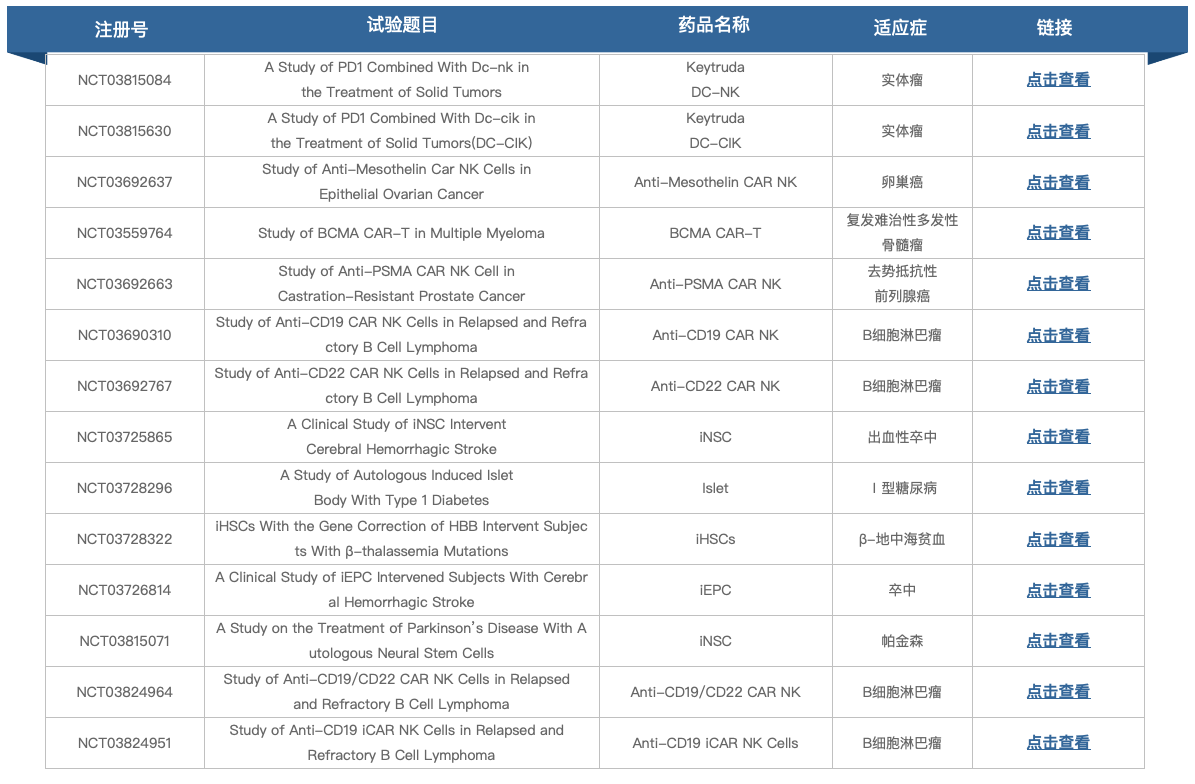
跟据clinicaltrials.gov显示,呈诺医学CRISPR-Cas9处理的诱导造血干细胞治疗β地中海贫血试验处于早期1期临床试验阶段,未有其他进展,官方网站也未查询到相关管线信息。
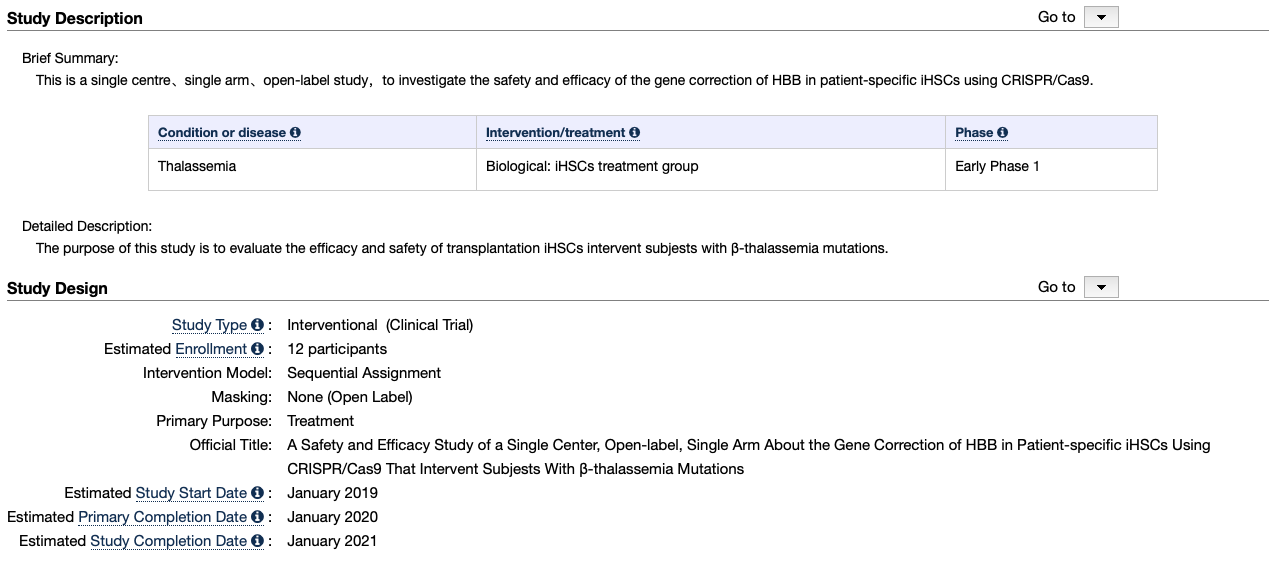 ▲图片来源:https://www.clinicaltrials.gov
▲图片来源:https://www.clinicaltrials.gov
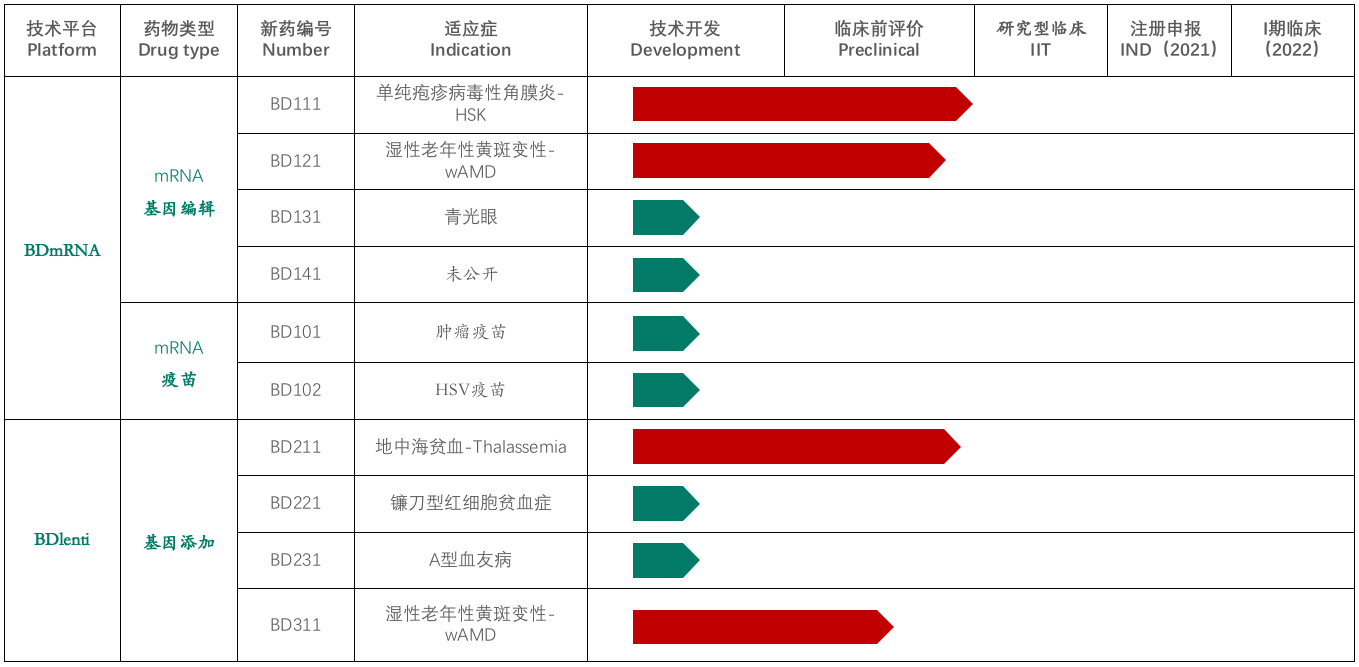
本导基因成立于2018年,是一家基因治疗创新药物开发的企业,拥有mRNA递送与基因编辑平台、第四代慢病毒载体平台、溶瘤病毒平台,主要用于治疗糖尿病黄斑变性、湿性老年黄斑变性(wAMD)、造血系统遗传疾病等疾病。
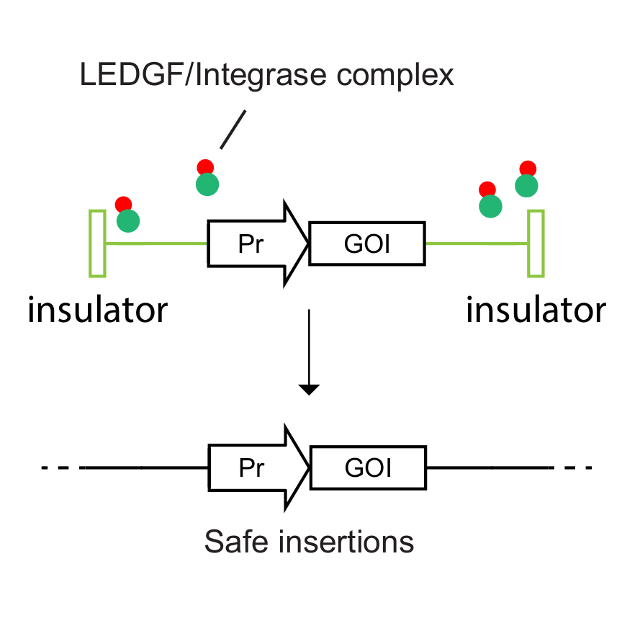
本导基因的基因添加——BDlenti平台使用先进的慢病毒载体递送技术,有效地提高了病毒产量以及造血干细胞的感染效率。BDlenti递送技术加入了独特的优化策略,可以降低基因整合突变的风险。同时,让治疗性基因在患者体内长期表达,而不会因为基因沉默而失掉疗效。
 ▲图片来源:本导基因官方网站
▲图片来源:本导基因官方网站
基于BDlenti递送技术,本导基因开发了治疗地中海贫血症的基因疗法BD211,目前也是公司开发的产品管线中进展较快的基因疗法之一,适应症还包括镰刀形红细胞贫血症,但目前仅处于技术开发阶段。此外,本导基因还在2020年6月完成了千万级人民币的pre-A轮融资,用于推进基于mRNA递送的基因治疗产品的临床应用。
 ▲图片来源:本导基因官方网站
▲图片来源:本导基因官方网站
上海邦耀生物科技有限公司成立于2013年,依托在基因编辑、免疫学领域的强大技术实力和科研团队,致力于基因编辑与细胞治疗的研发与转化,以及基因突变引起的遗传疾病的基因治疗。
邦耀生物已搭建基因编辑、细胞治疗与基因治疗三大具有自主知识产权的技术平台,其中基因编辑治疗β 地中海贫血症、PD1定点整合的非病毒CART、以及UCART等项目已经取得优异临床效果。
 ▲图片来源:邦耀生物官方网站
▲图片来源:邦耀生物官方网站
2019年3月,Nature Medicine在线发表了邦耀生物关于基因编辑疗法用于地贫治疗的研究成果。结果表明,通过CRISPR/Cas9技术重新开启胎儿期的γ珠蛋白的表达,从而代替有缺陷的β珠蛋白,达到缓解地贫症状的目的,具有很大的临床转化潜力。
瑞风生物成立于2019年,是一家以基因编辑为核心技术的药物创新企业,目前处于临床前阶段。
基于革新性的基因编辑技术,瑞风生物目前在遗传病、复杂疾病和肿瘤领域等皆有管线布局,其中进展最快的β-地中海贫血基因编辑疗法。
 ▲图片来源:瑞风生物官方网站
▲图片来源:瑞风生物官方网站
除制药企业之间的合作,还有医院与企业合作共同开发β地中海贫血基因疗法,如广州南方医院与广东铱科基因科技有限公司共同申报一项基因治疗重症β地中海贫血的研究(NCT03276455),铱科基因是赛尔生物的控股子公司,首席研究员李春富博士有“中国地贫之父”之称,目前该研究处于1/2期临床研究阶段;意大利IRCCS San Raffaele医院使用GLOBE慢病毒载体转导自体HSC的策略,与Orchard等共同申报的β 地中海贫血基因治疗临床试验正处于I/II期临床试验阶段(NCT02453477),这也是第一个同时应用于成人和儿科患者的β 地中海贫血基因治疗临床试验。
镰状细胞病(Sickle Cell Disease,SCD)是一组由β-珠蛋白基因突变引起的遗传性红细胞疾病。正常情况下,健康的红细胞呈圆盘状,易于在血管中移动,将氧气输送至身体的各个部位,但基因突变所导致的镰状红细胞阻碍血液流动,从而引发贫血等其他严重问题,特别是血管阻塞性危象(vaso-occlusive crises,VOC)。VOC也被称为镰状细胞疼痛危象(sickle cell pain crisis,SCPC),是由多细胞粘附或阻断血流的细胞簇所触发,可导致严重的急性和慢性危及生命的并发症和死亡。它是SCD患者急诊室就诊和住院的最常见原因,在SCD患者中,当多个血细胞粘在一起并黏附在血管上时,VOC就会发生,导致阻塞,但是目前能够预防VOC的方案也非常有限。
目前,针对SCD的治疗方法包括药物治疗、输血和干细胞移植。
最早被批准用于治疗镰状细胞疾病的药物是Hydroxyurea(羟基脲),但该药物只能用来缓解症状,并不能治愈;2017年,Emmaus Medical公司研发的Endari(L-谷氨酰胺口服粉剂)被FDA批准用于治疗5岁及以上的SCD患者,有助于限制血管阻塞性危象的持续时间、严重程度和发生频率;2019年,有两款治疗SCD的药物获得FDA的上市批准,分别是诺华研发的Adakveo(Crizanlizumab)与Global Blood Therapeutics(GBT)研发的Oxbryta(Voxelotor),Crizanlizumab是首款获批治疗VOC的靶向疗法,2020年在欧洲也获得了批准;但目前这两款药均未在国内获批。干细胞移植法可以治愈SCD,但是供体来源有限,在临床上也有诸多局限。
2017年,国际权威医学期刊《新英格兰医学杂志》(NEJM)上发表了一项研究成果,通过基因治疗“治愈”了一位15岁镰状细胞病患者。能彻底治愈SCD的基因疗法被寄予厚望,目前大家也在进行积极的尝试。
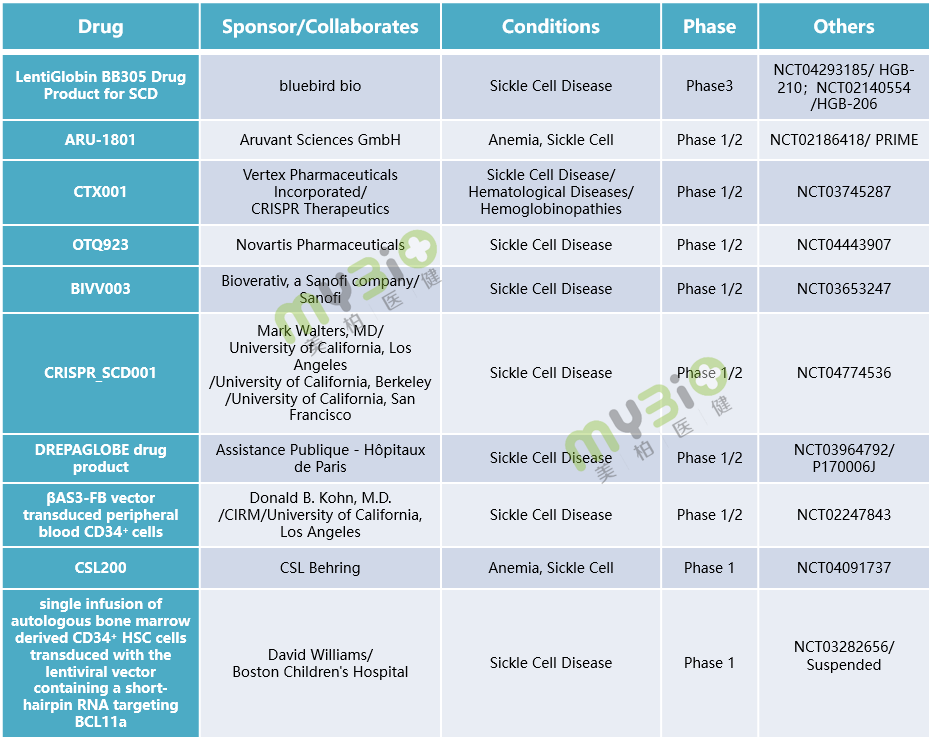 ▲表3 处于临床阶段的部分镰状细胞病基因治疗
▲表3 处于临床阶段的部分镰状细胞病基因治疗基因疗法区别于传统小分子、单双抗药物等治疗方式,在治疗具有遗传性的血液疾病上具有独特的优势,大多数公司在开展试验研究时可能也不止选择一个适应症。如同一种基因疗法可能会应用于治疗地中海贫血与镰状细胞病中,前者是应用基因疗法技术改变血红蛋白结构,后者是改变细胞形状。
研发基因疗法用于治疗镰状细胞病的代表公司:
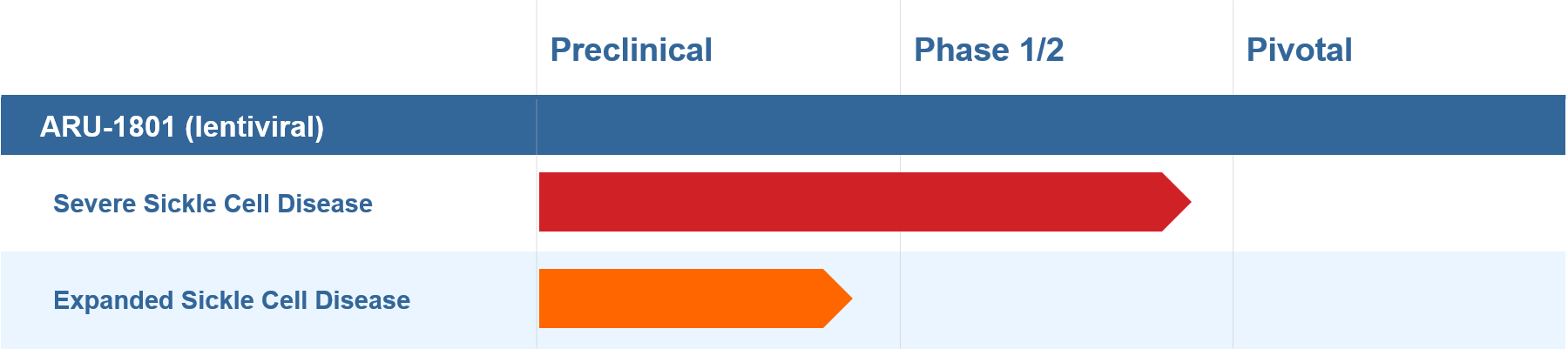
瑞士生物制药公司Roivant Sciences的子公司Aruvant Sciences是一家临床阶段生物制药公司,致力于开发针对罕见疾病的变革性疗法并将其商业化。
Aruvant的主要候选产品ARU-1801是一种针对SCD的个体潜在治愈型慢病毒基因疗法,目前正处在临床试验阶段。作为一次性治疗SCD的基因疗法,ARU-1801目前已经获得FDA治疗SCD的罕见儿科疾病资格认定(RPD)和孤儿药资格(ODD)以及EMA授予的优先药品资格(PRIME)。
 ▲图片来源:Aruvant 官方网站
▲图片来源:Aruvant 官方网站
CSL Behring是澳洲最大上市医疗公司、全球血液制品巨头CSL的子公司。上文在介绍UniQure的血友病管线时也提到,CSL Behring与UniQure就B型血友病患者的基因治疗产品达成合作,早前CSL Behring也曾收购美国生物科技公司Calimmune及其专有的体外造血干细胞基因治疗平台,其造血干细胞基因疗法便是用于治疗镰状细胞疾病及b地中海贫血。
CSL Behring研发管线中,除治疗SCD的基因疗法CSL200外,也有血浆衍生血红素疗法CSL889,该疗法也获得了欧盟委员会和FDA的孤儿药资格认定。此外,还有已上市的治疗A型血友病的AfstylaÒ与治疗B型血友病的IdelvionÒ。
 ▲图片来源:CSL Behring官方网站
▲图片来源:CSL Behring官方网站
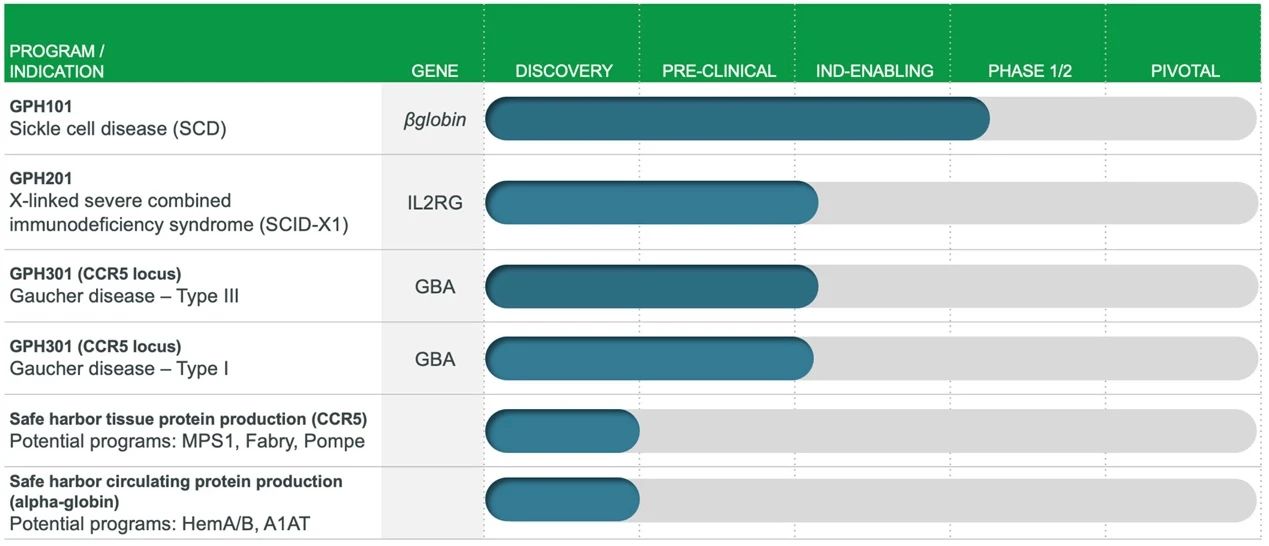
Graphite Bio创立于2019年,是一家美国基因编辑技术服务商,Graphite的技术方法基于其科学联合创始人Matthew Porteus博士和Maria Grazia Roncarolo博士的学术成果,Matthew Porteus博士同时也是CRISPR Therapeutics的科学创始人。Graphite成立时间虽短,但已经进行了两轮融资,在2021年的3月15日,Graphite完成了1.5亿美元的B轮融资,此前完成4500万美元的A轮融资。
Graphite Bio主要利用基因编辑与造血干细胞移植技术进行疗法开发。目前,Graphite管线上已经有6款在研基因疗法,适应证包括SCD、X连锁重症联合免疫缺陷病和戈谢病等。2020年12月,Graphite宣布,治疗SCD的候选药物GPH101的IND申请已获FDA批准,首个临床I/II期试验即将启动,Graphite计划2021年初开始招募CEDAR临床试验,也让我们期待这项试验结果(clinicaltrials.gov上尚未收录)。
 ▲图片来源:Graphite 官方网站
▲图片来源:Graphite 官方网站
Intellia公司成立于2014年,公司创始人詹妮弗·杜德娜(Jennifer Doudna)获得 2020 诺贝尔化学奖,是CRISPR基因编辑领域的权威人士。
OTQ923/HIX763是Intellia与Novartis合作开发的一种基于CRISPR/Cas9基因组编辑的造血干细胞(HSCs)疗法,用于治疗SCD。Novartis对于基因治疗领域也在积极布局,2018年,Novartis以87亿美金收购基因治疗公司AveXis,并获得全球首个治疗SMA的基因治疗产品Zolgensma;2020年,Novartis又以2.8亿美元收购Vedere Bio公司,并获得其全套的眼科疾病基因治疗平台,扩大在基因治疗和细胞疗法领域的优势。目前,Novartis在基因领域有4项临床项目、19个临床前项目。
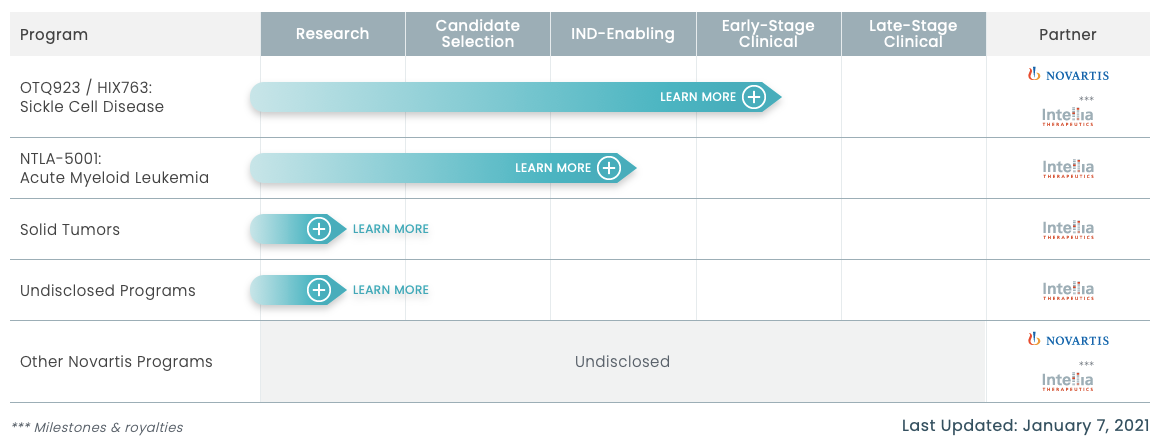 ▲图片来源:Intellia官方网站
▲图片来源:Intellia官方网站
Beam成立于2017年,是首家利用单碱基编辑技术开发精准基因药物的生物技术公司,由张锋教授、David Liu教授以及J. Keith Joung教授共同创立。2020年2月,Beam在纳斯达克上市,IPO当日募集超1.8亿美元;2021年2月,Beam宣布,以1.2亿美元收购用于基因疗法的非病毒载体递送工具的开发商Guide Tx,加码基因疗法研究。
在Beam的产品管线上我们能看到,暂时还未有在研候选产品进入临床试验阶段。Beam用于治疗血液疾病的基因疗法BEAM-101和BEAM-102是基于电穿孔技术,将基础编辑工具插入从患者体内提取的细胞中,以治疗TDT和SCD,预计会在2021年内开始第一次人体临床试验。
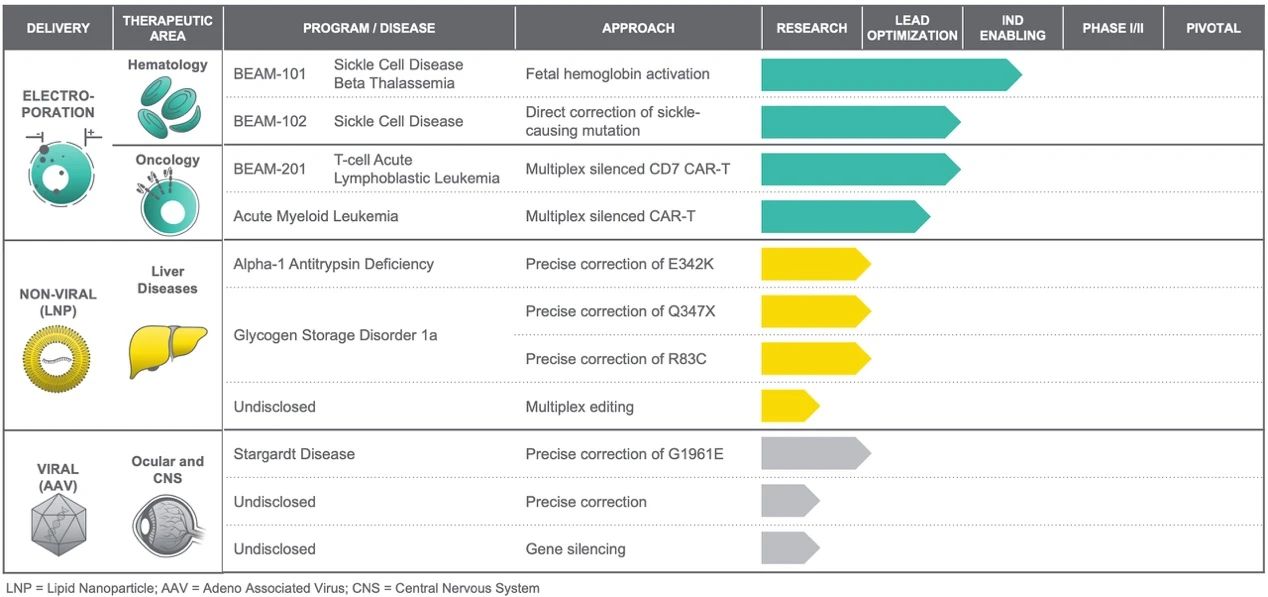 ▲图片来源:Beam官方网站
▲图片来源:Beam官方网站
加利福尼亚大学Mark研究了一种治疗SCD的疗法 CRISPR_SCD001,该疗法使用CRISPR/Cas9编辑过的造血干细胞(称之为CRISPR_SCD001药品)进行移植(HSCT)。另外还有像上文中提到的bluebird bio、CRISPR Therapeutics、Editas Medicine、本导基因等制药企业、科研院校及机构也在积极开发SCD的基因疗法。
范可尼贫血(Fanconi anemia,FA)是一种罕见的常染色体隐性遗传性血液系统疾病,与DNA链间铰链修复缺陷而引起的染色体不稳定有关。除典型的血液系统症状之外,还可能伴随骨骼畸形、性发育不全等,甚至可导致严重的并发症如骨髓衰竭、急性髓样白血病(AML)、骨髓增生异常综合症(MDS)等。2018年5月国家卫健委公布的《第一批罕见病目录》中,范可尼贫血与地中海贫血均被收录。
对于范可尼贫血的第一线治疗是雄性激素疗法和造血生长因子疗法,但是只有50%-75%的患者对药物治疗有反应。雄激素疗法代表药如羟甲烯龙(oxymetholone),在治疗中通常是羟甲烯龙联合较小量泼尼松,但在治疗期间要注意肝功损害等毒副作用问题;造血生长因子如G-CSF和GM-CSF能改善造血,特别是对于中性粒细胞减少的患者,能增加其中性粒细胞绝对值,代表药如首款口服血小板生成素艾曲泊帕(Eltrombopag,Promacta,Revolade)。
造血干细胞移植法(HSCT),特别是HLA匹配同胞供者异基因造血干细胞移植法(MSDallo-HSCT)是治疗范可尼贫血最有效方法,不仅能够治愈范可尼贫血患者,也能预防并发症白血病的发生,但仍需要面对供体来源的问题。 目前,基因治疗的研究正在火热进行中,临床上也亟需为范可尼贫血患者开发更有效的疗法。
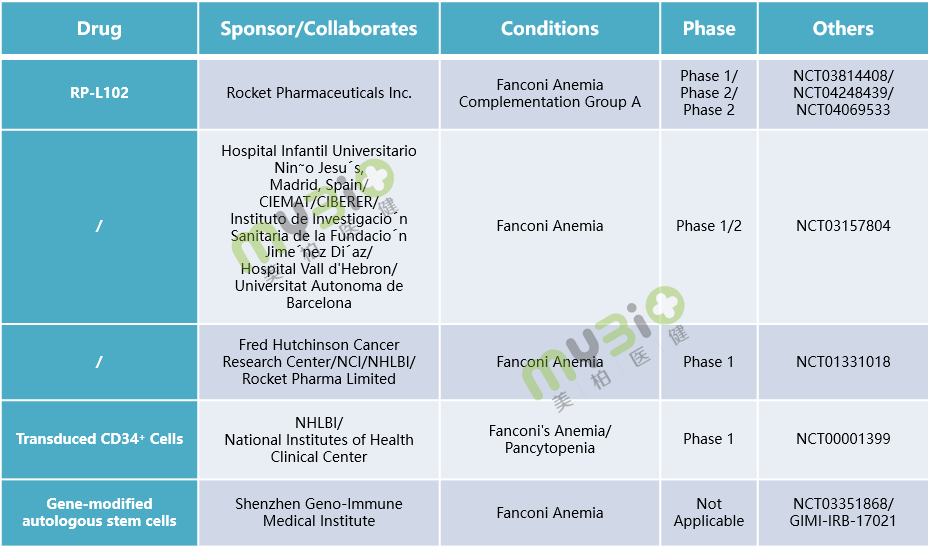 ▲表4 处于临床阶段的部分范可尼贫血基因治疗候选疗法
▲表4 处于临床阶段的部分范可尼贫血基因治疗候选疗法相对于其他的遗传性血液疾病如血友病、地中海贫血等,基因疗法用于范可尼贫血的研究相对较少,但这也并不影响我们从科学理论的角度出发,去相信基因疗法会成为范可尼贫血等疾病的终结者。
研发基因疗法用于治疗范可尼贫血的代表公司:
Rocket是一家多平台基因治疗公司,应用成熟的慢病毒载体(LVV)和腺相关病毒载体(AAV)基因治疗平台,开发罕见的、毁灭性疾病的基因疗法。
Rocket现有5项基因治疗候选产品,其中4项基于LVV平台所开发,1项基于AVV平台。目前进展最快的是用于治疗范可尼贫血的基因疗法RP-L102和用于促进白细胞粘附的基因疗法RP-L201。其他的基因疗法包括治疗Danon病的RP-A501、治疗丙酮酸激酶缺乏症(PKD)的RP-L301以及治疗小儿恶性骨硬化病(IMO)的RP-L401也均处在临床试验研究阶段。
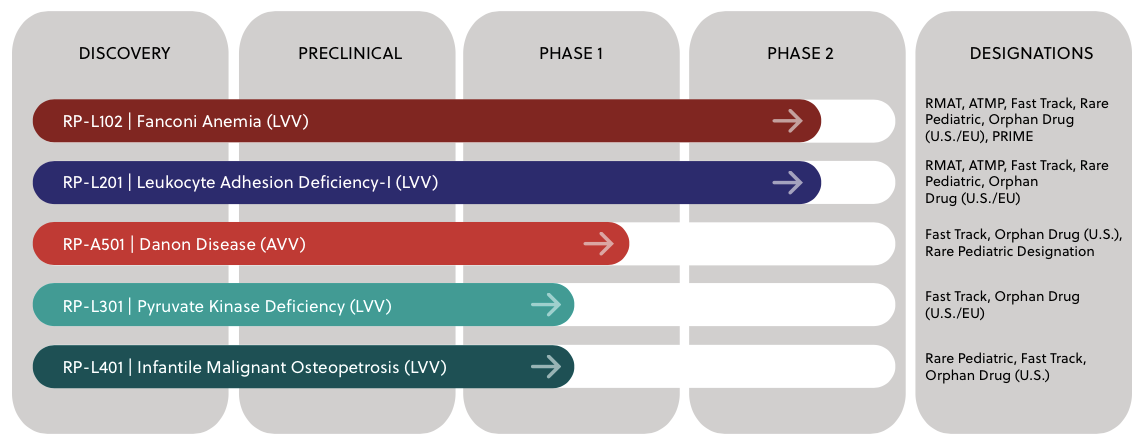 ▲图片来源:Rocket官方网站
▲图片来源:Rocket官方网站
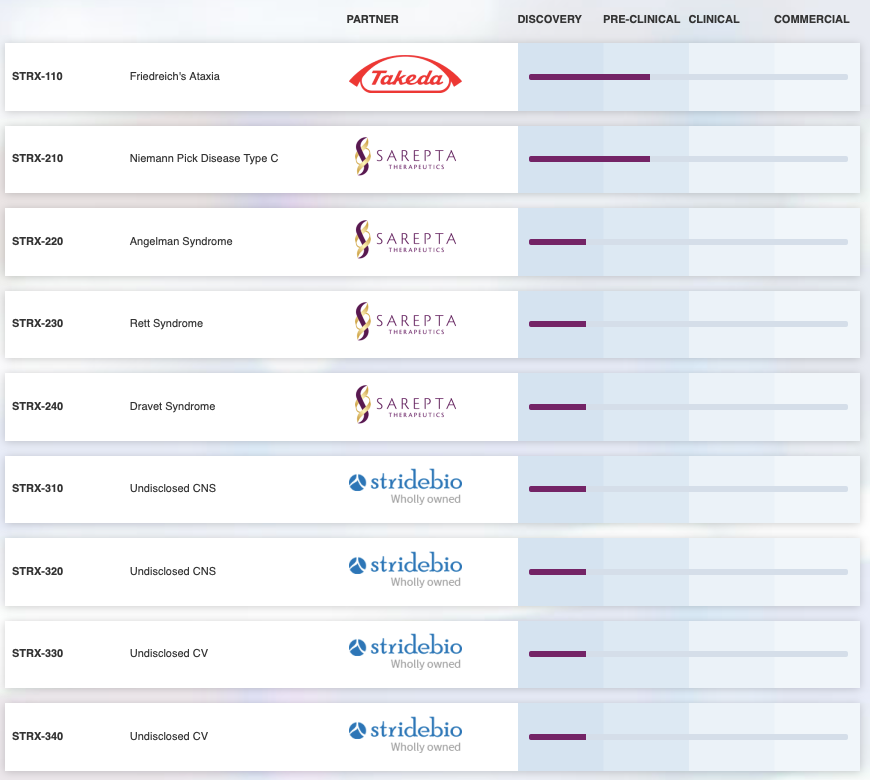
StrideBio成立于2015年,是一家专注于开发基于腺相关病毒(AAV)基因疗法的公司。StrideBio于2018年获得1570万美元的A轮融资,在2021年3月,StrideBio又完成超额认购的B轮融资8150万美元,该资金将用于进一步优化公司产品管线。
StrideBio利用其专有的STRIVE™平台,设计改造AAV载体,以呈现独特的AAV衣壳,改进基因疗法的组织特异性、转导效率等。基于该技术,StrideBio与Takeda、Sarepta等公司展开合作,管线中进展最快的是治疗范可尼贫血的基因疗法STRX-110与治疗尼曼匹克症C型的STRX-210。
 ▲图片来源:Stridebio官方网站
▲图片来源:Stridebio官方网站
另有消息称,Abeona公司曾采用一种新型的基于CRISPR/Cas9基因编辑方法的疗法ABO-301(AAV-FANCC)用于治疗范可尼贫血,但目前在该公司的研发管线中并未看到ABO-301的研究进展,其他渠道也未查到相关信息。
 ▲图片来源:Abeona官方网站
▲图片来源:Abeona官方网站
国内研究范可尼贫血进入临床阶段的是深圳市免疫基因治疗研究院,目前正在招募志愿者中,这也该研究院基因治疗血液遗传疾病的第三个研究方向。
 ▲图片来源:深圳市免疫基因治疗研究院官方网站
▲图片来源:深圳市免疫基因治疗研究院官方网站
基因疗法除能用于治疗血友病、地中海贫血、镰状细胞病及范可尼贫血等遗传性血液疾病外,也有研究者利用基因技术治疗血液肿瘤。
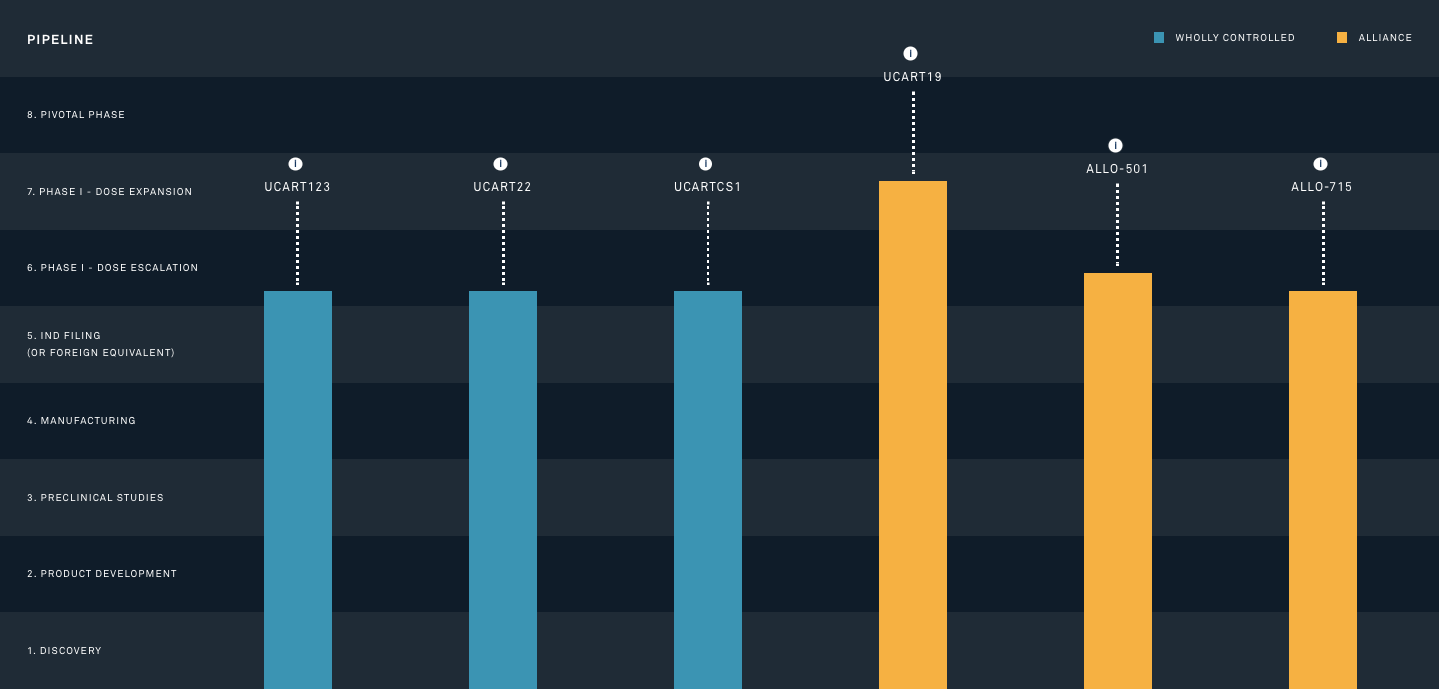
致力于异体CAR-T疗法开发的法国生物公司Cellectis开发了一款用于治疗急性髓系白血病(Acute myeloid leukemia,AML)的UCART123,该疗法通过TALEN技术基因编辑异体T细胞,使之特异性靶向AML和母细胞性浆细胞样树突状细胞肿瘤(Blastic Plasmacytoid Dendritic CellNeoplasm,BPDCN)细胞表面的CD123抗原而发挥作用。2017年2月,UCART123获得美国FDA的IND批准,用于治疗成为第一款由FDA批准进入临床试验的此类产品,但UCART123后续的临床试验并不顺利。同年9月,临床试验中便出现了一个BPDCN的患者死亡事件,随后就被FDA叫停,并要求Cellectis在安全性上重新设计,2个月后FDA才恢复该疗法的临床试验,根据clinicaltrials.gov显示,目前该疗法仍处于1期临床试验阶段。
 ▲图片来源:Cellectis官方网站
▲图片来源:Cellectis官方网站
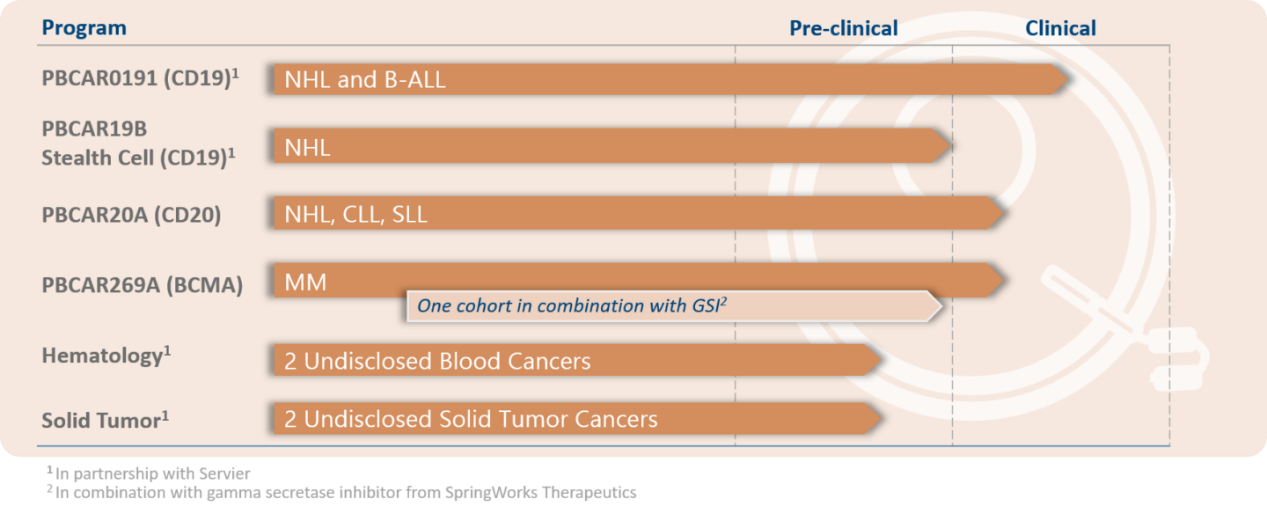
不仅是Cellectis公司,Precision BioSciences/施维雅也开发了CD19导向、同种异体嵌合抗原受体T细胞疗法(CAR-T)PBCAR0191,用来治疗晚期B细胞前体急性淋巴细胞白血病(B-ALL)。Precision通过其专有的ARCUS®基因组编辑平台在体外对T细胞进行修饰,在T细胞受体(TCR)位点插入CAR基因并同时敲除TCR,进行体外扩增后再回输至患者体内以达到治疗目的。基于该平台技术,Precision也构建了包括多个通用型CAR-T免疫细胞疗法和数个体内基因校正疗法的管线。2019年3月,PBCAR0191正式开启了1期临床试验,适应症包括B-ALL和非霍奇金淋巴瘤,根据clinicaltrials.gov显示,目前该疗法处于1/2期临床试验阶段。
 ▲图片来源:Precision官方网站
▲图片来源:Precision官方网站
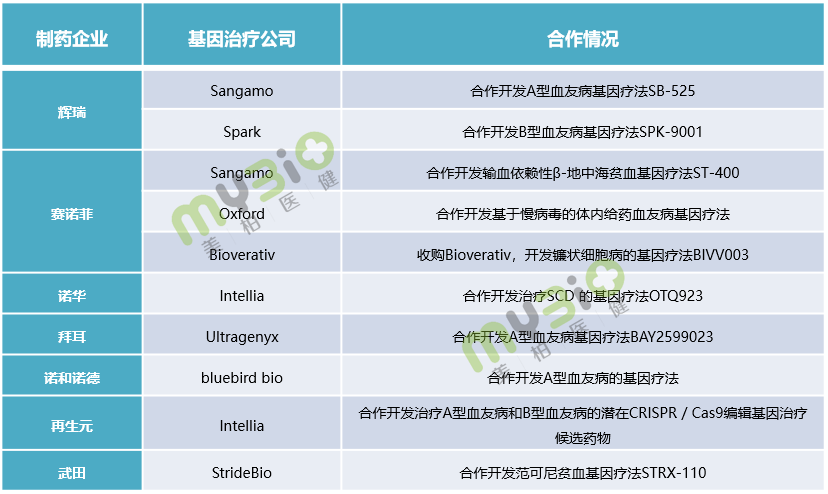
除上述Biotech之外,越来越多的大型制药公司正在积极投入到基因疗法的布局中,通过并购、合作开发等方式介入这一领域,获得强劲的竞争力量。像文中提到的辉瑞、赛诺菲、诺华等公司就在血友病、地中海贫血等血液疾病领域与基因治疗公司合作开发。
 ▲表5 部分大型制药企业在血液遗传病领域的合作情况
▲表5 部分大型制药企业在血液遗传病领域的合作情况
综合来看,国外的基因治疗行业大步向前,国内的企业也在快速追赶。就本篇内容分析,全球开展基因治疗血液遗传疾病临床试验研究最多的国家是美国,大概占比65%,中国也在积极开展,占比近20%,其他国家如英国、意大利、西班牙、法国等也在进行血液疾病的临床研究,但与美国和中国相比还是较为落后;并且,这些研究与开发血液遗传病基因疗法的企业一半也是注册在美国,还有约三分之一是中国企业,我国的基因行业正逐渐兴起。目前,美国的基因治疗进展仍稳居首位,我国虽紧随其后,但也有一定的距离,这有可能是长久以来,两国在生物领域这一大板块上科研和技术的水平、临床治疗经验的积累以及政策监管的实施和投入等多方面差距导致的。
在血液遗传病的基因治疗领域,仅有治疗β 地中海贫血的Zynteglo获EMA批准有条件上市,其他进展较快的、有希望紧随其后上市的属适应症为SCD的Zynteglo(β 地中海贫血获批)、BioMairn的BMN270、Sangamo/辉瑞的SB-525,这些产品均处于3期临床试验阶段。国内基因治疗领域的研究虽在数目上比较乐观,但临床研究基本处在临床前或1期临床试验阶段,不过国内的监管部门也随着这一技术的快速发展而不断出台新的相关政策,以更加规范、全面的实施监管。基因疗法也许会成为中国实现弯道超车,拉近与国外生物技术水平距离的机会。在2020年10月,我国也迎来了首个CRISPR基因编辑疗法临床试验申请,这一里程碑事件也会激励着越来越多国内新兴技术的企业取得革命性的突破。
基因疗法能够从“根本”去解决问题,所以,该治疗方案被认为有望治愈传统药物不能解决的疾病。对于如血友病、地中海贫血、镰状细胞病等的血液遗传疾病,基因疗法是较为理想治疗方案,通过改造缺陷基因达到彻底治愈疾病的目的;其他比较热门的适应症还包括遗传性眼部疾病如遗传性视网膜疾病、遗传性视神经病变等。随着技术的进步,基因疗法将会在越来越多的适应症上展现良好的治疗效果,我们应持续关注该领域的发展。