
此前,在美国第61届血液学会年会上,研究人员报道一种新型异体CD83嵌合抗原受体(CD83 CAR-T)。体内异种移植物抗宿主病(GVHD)模型评估结果显示,与模拟转导T细胞组的小鼠相比,注射CD83 CAR-T的小鼠可以显着提高存活率,注射第21天GVHD靶器官损伤几乎可以忽略,CD1c+、CD83+树突状细胞、CD4+、CD83+ T细胞和致病性Th1细胞在第21天时显著减少,Treg与同种异体Tconv的比值也显著增加,且显示出很好的耐受性。此外,研究表明CD83 CAR-T能有效杀死急性髓系白血病(AML)细胞系,靶点和肿瘤外的毒性可忽略不计。CD83 CAR-T细胞可以作为一种新的异体CAR-T疗法对髓系恶性肿瘤发挥杀伤的同时也能很好地避免GVHD的发生。
CAR-T疗法改变了血液恶性肿瘤治疗前景,目前虽已有两款针对血液恶性肿瘤的自体型CAR-T上市,但仍有一些瓶颈限制其发展。首先,目前自体型CAR-T的T细胞来源于患者自身,属于自身订制产品,且生产工艺复杂,周期较长,晚期病人在CAR-T细胞生产过程中病情不断恶化,可能错过最佳治疗时间,这在某些高度增殖性疾病(如急性白血病)患者中尤其成问题。其次,很多接受多次化疗的病人很难获得足量且健康的T细胞,这限制了CAR-T细胞的制备。最后,每个患者的T细胞都有差异,无法保证产品的稳定和质量控制,很难生产出标准化的产品。
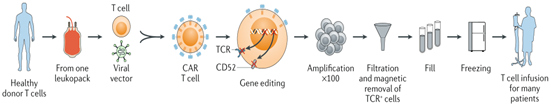 图1 自体CAR-T的生产工艺
图1 自体CAR-T的生产工艺与自体方法相比,使用利用健康捐赠者的细胞生产的异体CAR-T有许多潜在的优势,如易于规模化和批量生产从而降低了成本。大量的CAR-T细胞可以由单个供体生产,可以立即用于不同患者治疗,简化治疗流程。
然而,异体CAR-T也有两个常见的问题。首先,给药的同种异体T细胞可能导致移植物抗宿主病(GVHD)。其次,这些异体CAR-T细胞可能被宿主免疫系统迅速清除,限制其抗肿瘤活性。下文介绍不同来源的异体CAR-T疗法,以及优化当前异体CAR -T细胞的方法。
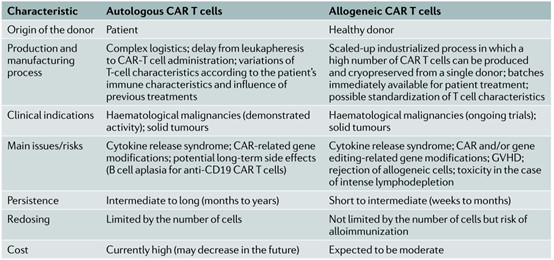 表1 自体CAR-T与异体CAR-T
表1 自体CAR-T与异体CAR-T
目前用于制造异体CAR-T的T细胞主要来源于外周血单个核细胞(PBMCs),少部分来源于脐带血(UCB)。原则上,这些T细胞也可以从再生干细胞中获得,如诱导多能干细胞(iPSCs)或胚胎干细胞。因为异体CAR-T细胞是由健康的供体产生的,与自体CAR-T细胞相比,这些细胞没有受到病人肿瘤的免疫效应或化疗药物的影响。根据免疫特性选择供体细胞可能是减少GVHD异质性的关键因素。
使用UCB衍生的CAR-T细胞可降低GVHD的发病率和严重程度。来源于脐带血的T细胞具有独特的抗原初始状态,这可能是脐带血移植物的同种反应性降低的原因。胎盘来源的干细胞可以用来产生T细胞或自然杀伤(NK)细胞。胎盘具有独特的HLA表达模式,与其它组织不同,绒毛外细胞滋养层细胞只表达HLA-C、HLA-E和HLA-G,合胞滋养层细胞HLA阴性。这些特异性对胎盘来源的T细胞的影响暂时还没有相关研究报道。
iPSCs的T细胞也可以作为异体CAR-T细胞的来源。理论上讲,iPSCs细胞系具有无限的自我更新能力,可以无限期地储存和使用。可以用具有共同HLA单倍型的iPSCs以最小化iPSCs CAR-T细胞的免疫排斥反应风险。使用iPSCs的另外一个优点是CAR-T细胞是由一个克隆多能干细胞系产生的,因此是均匀的。
供体和受体之间的HLA不匹配触发免疫识别,可能导致移植物排斥反应及GVHD。GVHD是SCT发病和死亡的主要原因,研究表明αβ 型T细胞在急慢性GVHD发病中起着重要作用。αβ型T细胞的TCR识别主要组织相容性复合物(MHC)分子(人类的HLA系统)位点。而MHC位点是人类基因组中最具多态性的区域,导致了成千上万的MHC差异表达。αβ 型T细胞与外源MHC分子相互作用,是移植排斥反应和GVHD的关键。目前,有几种策略降低异体CAR-T疗法发生GVHD的风险。
这种方法仅限于接受同种异体干细胞移植(SCT)但随后复发的患者,在这种情况下,CAR-T细胞可以从原始供体中获得。在最近的一份报告中,20例B细胞恶性肿瘤患者输注来自同一供体的CD19 CAR-T细胞后,6例完全缓解,2例部分缓解,且无GVHD产生。缓解期患者血CAR-T细胞水平高于未缓解期患者,3周后CAR-T细胞显著下降。该结果显示异体来源的CAR-T细胞可能被纳入同种异体SCT的策略中,以增强移植物抗肿瘤效应,而不会增加GVHD的风险。
NK细胞最初被鉴定为具有杀死肿瘤细胞的能力,是机体天然肿瘤免疫监视的一个组成部分。NK细胞对细胞具有高度的肿瘤细胞溶解性,一些研究表明,不同类型的肿瘤中存在NK细胞功能障碍,说明肿瘤已经进化出逃避NK细胞杀伤的机制。因此,通过给NK细胞装备CAR来增强其抗肿瘤活性是一个很有吸引力的策略。Chu等人证明装备CAR的NK细胞增强了NK细胞的抗肿瘤活性。在另一项研究中,用来自健康供体的NK细胞表达一种EGFR 靶向CAR,显示出较好的抗胶质母细胞瘤活性。
外周血中NK细胞浓度相对较低,可采用体外特异性富集和扩增NK细胞的策略。表达IL-2 NK92细胞系已被批准用于人类。使用CD19 CAR–IL–15转导的NK细胞与CD19 CAR NK细胞对照相比,在异种移植小鼠淋巴瘤小鼠模型中具有更长的生存期。
γδ型 T细胞能对肿瘤细胞产生自然细胞毒性反应,在体外γδ 型T细胞可以大量扩增,且不诱发GVHD,因为其TCR的激活不受MHC的限制。靶向在神经胶质瘤和其它神经外胚层肿瘤中常过度表达的双唾液酸神经节苷脂GD2的γδ 型CAR-T增强了对表达GD2肿瘤的杀伤活性。
由于αβ型TCR是产生T细胞免疫反应的关键因素,研究人员已经开发出阻止TCR在αβ型T细胞表面表达的方法。基因编辑是当今最有前途的方法之一。αβ型T细胞表面的TCR蛋白复合物由α-链和β-链组成,β链基因包含两个恒定区域,而编码α链的只有一个。因此,敲除α链编码基因是破坏αβ型 TCR最直接的方法。Poirot等人利用TALEN技术从健康第三方供体生产TCR和CD52缺陷的CAR-T细胞,在小鼠模型中没有产生GVHD,并且对 Alemtuzumab有耐药性,该抗体可用于消灭宿主表达CD52的T细胞并避免同种排斥反应。
在最新研究中,研究人员将表达CAR的转基因直接插入到TRAC基因的位点,在破坏T细胞表达TCR的同时,让CAR转基因在TCR基因启动子调控下表达。动物试验表明,这种方法产生的靶向CD19的CAR-T疗法比随机插入CAR基因具有更好的抗肿瘤活性。
目前,多项在研的异体CAR-T疗法已经进入临床试验阶段,用于治疗急性淋巴细胞白血病和急性髓系白血病患者。
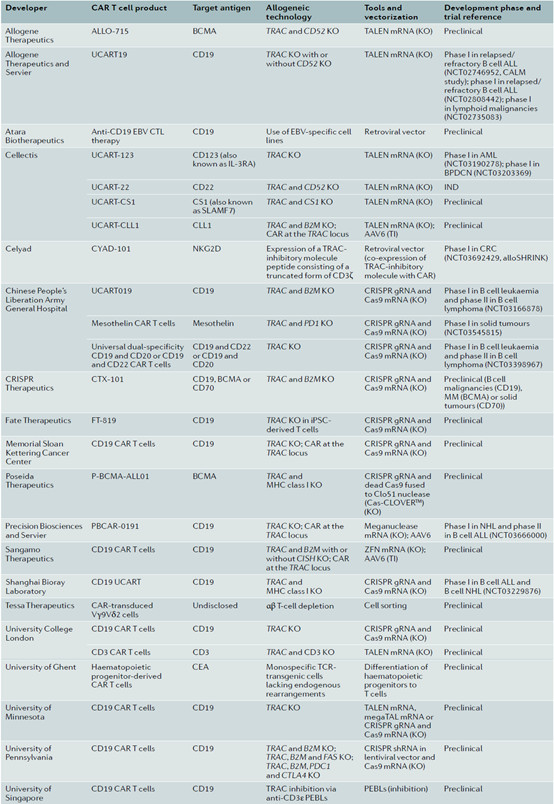
CAR-T细胞治疗已经改变了一些血液恶性肿瘤的治疗前景,目前仍然是最有希望的治疗癌症的方法之一。开发通用CAR-T细胞可即时用于患者治疗,降低治疗费用,显著增加该疗法的应用范围。基因编辑技术可通过控制TCR的表达来有效消除GVHD产生的风险。对于某些比较敏感的癌症来说,异体型CAR-T疗法在短期内就能起到很好的效果,因此不必过于担心免疫系统排斥的问题。而对于实体瘤,我们希望T细胞在肿瘤附近停留尽量久的时间,自体型CAR-T疗法则会有更大的发挥空间。目前,尽管在CAR-T治疗效率方面仍存在许多挑战,尤其是在实体肿瘤中。科研工作者也在发挥聪明才智来解决这些瓶颈,这个新的治疗方法可能会使癌症治疗发生革命性的变化。
转自:生物制药小编