
本周,来自哈佛-麻省理工学院Broad研究所等六所顶级研究机构的科学家们,又干了一件大事情。
由金鑫和Todd R. Golub领衔的研究团队,给500个人类癌症细胞系打上了特殊的标签,研究了它们的转移相关特征,创建了有史以来第一张关于不同癌症如何扩散的地图——MetMap[1]。
相关数据可以帮助科学家发现癌症转移的新细节,更深入地了解是什么驱动了癌症的转移,为什么一些癌症比其他癌症扩散得更凶猛,以及如何用新的癌症药物潜在地减缓或阻止转移这一致命的过程。
相关研究成果以封面报道的形式,刊登在顶级期刊《自然》上。Todd R. Golub是通讯作者,金鑫是共同通讯作者和第一作者。
 《自然》的封面
《自然》的封面
绝大多数的癌症相关死亡,是癌细胞的扩散转移导致的。
时至今日,我们对癌症转移的了解仍非常有限。几乎没有办法确定某个癌症是否会转移;如果转移,扩散的程度如何,会波及哪些组织或器官,也很难判断。
人类癌细胞系一直是科学家主要的研究对象,为人类对抗癌症立下汗马功劳。研究人员认为,可以利用人类癌细胞系,结合异种移植模型,研究数百个人类癌细胞系的器官特异性转移潜能,促进人类对癌细胞转移有更深入的认知。
然而,由于人类癌细胞系数量众多,逐个完成体内测试的话,一方面是费时、费力、费钱,另一方面实验过程中的变量不易控制。
因此,金鑫和Todd R. Golub提出了一个新的高通量研究方法。
他们先给每一个癌细胞系做了DNA条形码标记,然后将所有需要研究的癌细胞系混合在一起,注射到免疫缺陷小鼠体内。五周之后,再采集小鼠不同组织或器官的样本,完成高通量测序,看看不同的组织或器官中各种DNA条码的量。
从理论上讲,通过这种方法可以了解不同癌细胞系的转移偏好性以及扩散路径。这个研究思路看上去简单,不过金鑫博士研究的可是500个癌细胞系,难度和工作量可想而知。
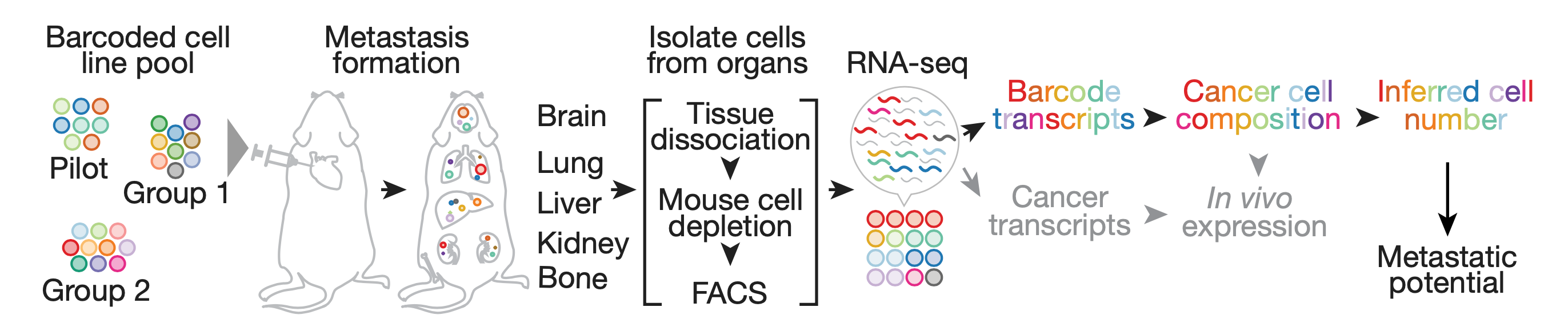 研究方法
研究方法
金鑫博士先用4个乳腺癌细胞系检验了他的想法,证实可行性之后,又在21个基底样乳腺癌细胞系中进一步证实该方法的可靠性。
从目前已经发表的研究成果来看,基底样乳腺癌在患者中具有多样化的转移能力[2]。金鑫博士的研究得到了一致的结论:21个癌细胞系的转移模式多样。
例如,MDAMB231等广泛转移定植,HCC1954主要入侵大脑,HCC1143等完全不转移 。值得注意的是编号为BT20的癌细胞系,在多个器官中被检测到,但在所有器官中的丰度都很低,这反映了它有定植能力,但没有扩张能力。
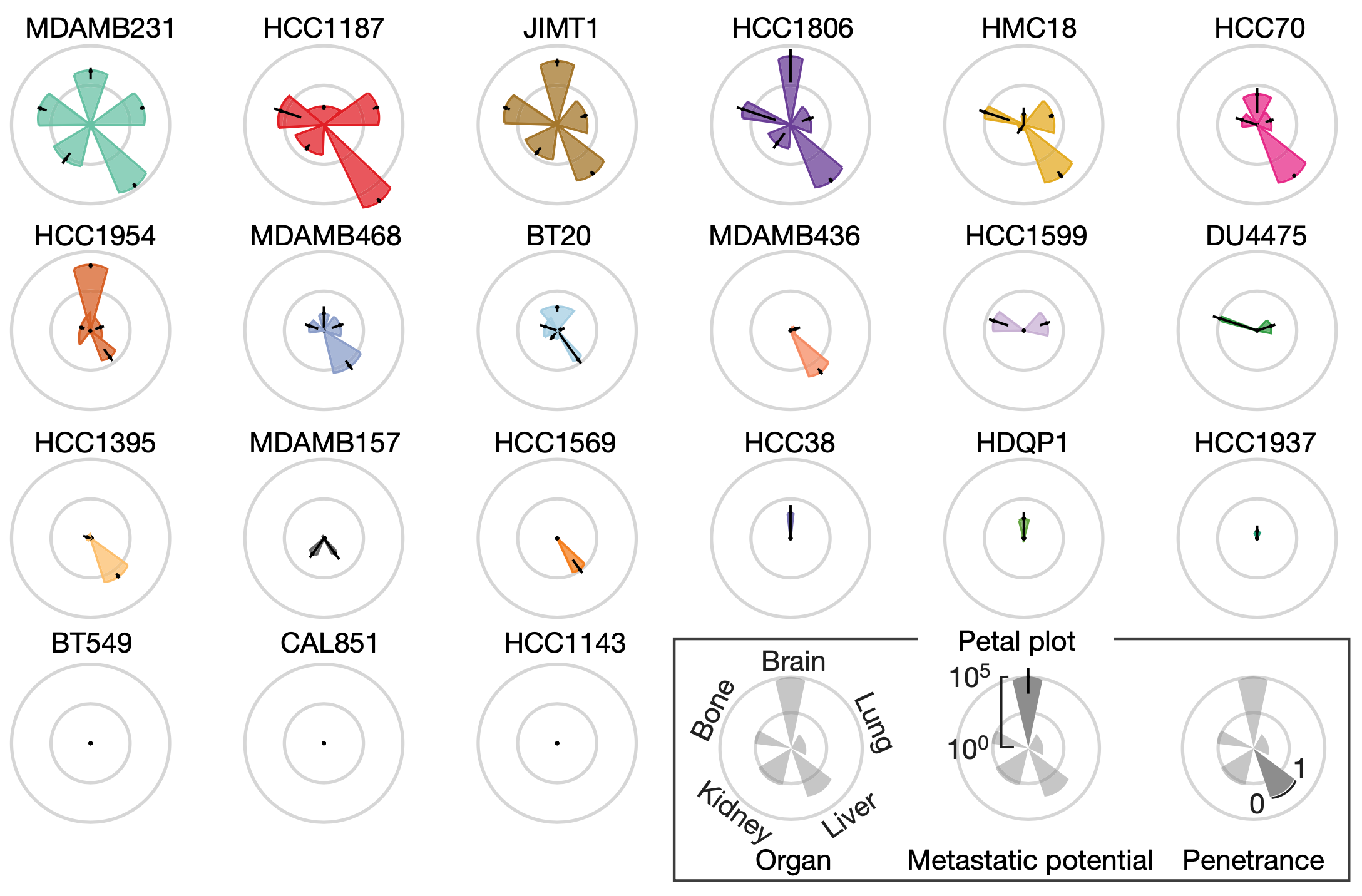 21个乳腺癌细胞系的转移图谱
21个乳腺癌细胞系的转移图谱
乳腺癌细胞系的研究数据,证实了上述研究思路的可行性。于是,金鑫博士将这种方法应用于跨越21个癌种的503个癌细胞系,以构建一个全系癌细胞转移图谱(MetMap)。
而且为了检验转移图谱数据集的稳定性,金鑫博士等还特地构建了两种不同细胞系模式:一个是给模式小鼠一次性注射498个癌细胞系(MetMap500);另一个是注射5个癌种的各25个癌细胞系,累计125个癌细胞系(MetMap125)。
研究人员发现,无论是改变注射的癌细胞数量,还是改变测试小鼠年龄和队列大小,得出的结果都没有随这些参数发生大幅变化。这一方面说明癌细胞转移潜力的相关性很强,另一方面表明该方法是非常稳健。
 研究方法稳定
研究方法稳定
那么通过这种方法取得的数据是否反映了癌症在人体内的转移行为呢?
为了解答这个问题,金鑫博士分析了细胞系的现有临床注释。基于此,他们发现癌细胞转移的潜能与癌症的类型、来自原发灶还是转移灶,以及患者的年龄相关;与患者的性别、人种没有相关性。
例如,黑色素瘤和胰腺癌在人体内倾向于转移[3],金鑫博士在研究中也观察到了同样的倾向。相比之下,来源于脑肿瘤的细胞系一般是非转移性的,之前的基础研究也发现它们确实有不易发生血源性扩散的倾向[4,5]。其他还有很多类似的一致结论,我这里就不再一一列举。
有一个出乎意料的现象是:癌细胞的转移潜能降低与患者年龄增加之间竟然存在相关性。对于这一点,研究人员表示需要进一步的研究确定。
 癌细胞的转移潜能与年龄之间的关系
癌细胞的转移潜能与年龄之间的关系
此外,金鑫博士等还发现,癌细胞系的转移潜能并不能简单地用体外增殖速度或突变负担来解释,这表明转移的背后应该还有更精妙的分子机制不为人所知。
为了进一步揭示背后的分子机制,金鑫博士等以乳腺癌及其脑转移为研究切入点,从体细胞突变、DNA拷贝数变异、转录组、代谢组、CRISPR-Cas9功能性基因组全面筛选等角度,深入展开了研究。
经过层层深入分析,金鑫博士等逐渐发现乳腺癌细胞系的脑转移潜能与脂质合成之间有很强的相关性。代谢组分析发现,高脑转移癌细胞中胆固醇种类的水平增加,三酰甘油(TAGs)水平的全面下降。相比之下,非脑转移癌细胞的TAGs水平较高。
实际上,大脑也不是将脂肪酸作为TAGs储存,而是积累专门的脂质来支持神经活动和大脑功能[6,7]。
 不同组织器官的脂类水平
不同组织器官的脂类水平
研究人员认为,这种现象背后的可能原因是,其他组织中富含的TAGs等在大脑中并不丰富,乳腺癌细胞要想在大脑微环境中生存,它们必须通过其他途径获取脂质,这符合种子与土壤假说[8]。
通过CRISPR-Cas9功能性基因组全面筛选的方法,金鑫博士等发现介导上述脂代谢状态变化的是转录因子SREBF1。SREBF1的敲除会导致癌细胞内TAGs水平增加,胆固醇等的水平下降。
基于以上的遗传、代谢、转录组和功能基因组证据,不难发现SREBF1介导的脂质代谢与乳腺癌的脑转移之间存在关联。后续研究还发现,SREBF1不是癌细胞播种必需的,而是在癌细胞在大脑微环境中增殖所必需的。
一个药物研发的新方向就这样出现了。
总的来说,金鑫和Todd R. Golub领衔的研究团队首次构建了500个人类癌细胞系的转移图谱,证明了研究方法的可行性和有效性,还以乳腺癌脑转移为例,为新药研发找到了新靶点。
参考文献: