
淋巴细胞是血液循环中五种常见的白细胞之一。虽然成熟的淋巴细胞看起来都很相似,但它们的功能却非常不同。最丰富的淋巴细胞有:B淋巴细胞(通常称为B细胞)和T淋巴细胞(也称为T细胞)。B淋巴细胞,也叫B细胞,是淋巴细胞亚家族白细胞中一员。B细胞来源于骨髓的多能干细胞。禽类是在法氏囊内发育生成,故又称囊依赖淋巴细胞(bursa dependent lymphocyte)/骨髓依赖性淋巴细胞。与T淋巴细胞相比,B细胞的体积略大。这种淋巴细胞受抗原刺激后,会增殖分化出大量浆细胞。浆细胞可合成和分泌抗体并在血液中循环。每个B细胞都是针对特定抗原的。结合的特异性存在于抗原的BCR (B细胞受体)中。它们是完整的膜蛋白,以成千上万个相同拷贝的形式暴露在细胞表面,是在细胞遇到抗原之前产生的。其主要功能是在体液免疫中分泌抗体。此外,B细胞可以呈递抗原和分泌细胞因子。可以在其细胞膜表面表达B细胞受体,结合抗原,并诱导抗体的产生。
哺乳类动物B细胞的分化过程主要可分为前B细胞、不成熟B细胞、 成熟B细胞、活化B细胞和浆细胞五个阶段。其中前B细胞和不成熟B细胞的分化是抗原非依赖的,其分化过程在骨髓中进行。抗原依赖阶段是指成熟B细胞在抗原刺激后活化,并继续分化为合成和分泌抗体的浆细胞,这个阶段的分化主要是在外周免疫器官中进行的。B细胞能够执行多种细胞和体液免疫功能取决于B细胞所处阶段的分化和激活状态。
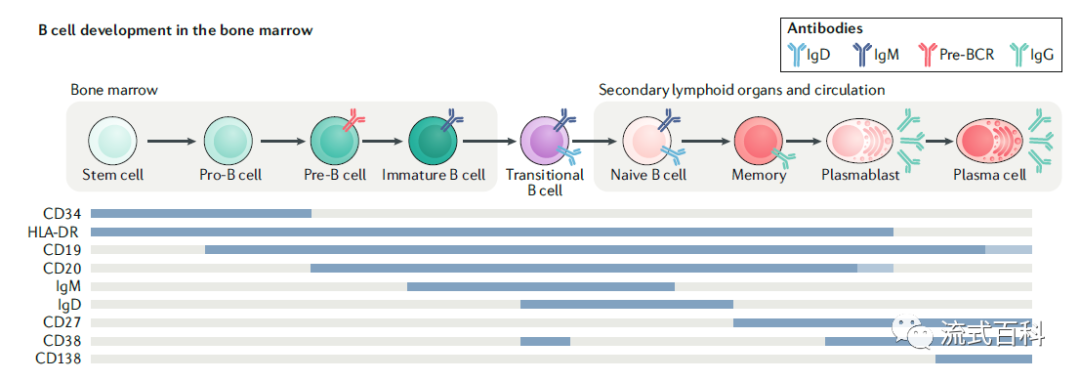
骨髓中的pro-B细胞丢失CD43,即转化为前B细胞(Pre-B cell)。Pre-B 细胞是从骨髓中淋巴干细胞分化而来,只存在于骨髓和胎肝等造血组织。Pre- B细胞无膜表面Ig的表达,因此缺乏对抗原的反应能力,对抗原无应答能力。CD19、CD20和MHCⅡ类HLA-DR抗原在此阶段开始表达。
不成熟B细胞(immature B cell)开始表达mIgM,但如与抗原结合,则产生负应答,使B细胞转变为受抑制状态,不能继续分化为成熟的B细胞,这是形成自身免疫耐受的机制之一。不成熟B细胞CD19、CD20和MHCⅡ类抗原表达量增加,并可开始表达CD21抗原。
骨髓中发育成熟B细胞(mature B cell)经血液迁移至外周淋巴器官,此时膜表面同时表达mIgM和mIgD,mIgD的表达防止了B细胞与抗原结合后所引起的免疫耐受。成熟B细胞表达补体受体1(CR1)、致有丝分裂原受体以及多种细胞因子受体。 到了Naive B cells 能够共表达 IgM 和 IgD,可以留在循环或迁移到次级淋巴器官。一旦遇到抗原Naive B细胞就会进一步分化成memory B,最终发展成浆细胞。
浆细胞(plasma cell PC)又称抗体分泌细胞(antibody secreting cell)。成熟B细胞接受抗原刺激后,在抗原提呈细胞和Th细胞的辅助下成为活化B细胞,进而分化为浆细胞,合成和分泌各类免疫球蛋白,同时获得了PC-1(plasma cell antigen-1)等浆细胞特异性标志,而mIg,MHCⅡ类抗原、CD19、CD20、CD21等标记消失。
所有血液细胞的祖先都是造血干细胞。造血干细胞可以分化为髓样干细胞和淋巴样干细胞,淋巴样干细胞在不同的器官中进一步分化为NK细胞、B细胞和T细胞。其中,B细胞的分化主要在骨髓完成。经过一系列细胞因子刺激以后,淋巴样干细胞分化形成成熟B细胞(狭义的B细胞),进入到血液或淋巴循环。成熟B细胞的寿命一般为2-4个月,如果成熟B细胞的增殖和凋亡失去控制,则容易演变成B细胞淋巴瘤和B淋巴细胞白血病等。成熟B细胞在外周血或淋巴中接触外界抗原,进一步形成能分泌抗体的浆细胞。如果浆细胞的增值和凋亡失去控制,则易引发浆细胞瘤,最常见的浆细胞肿瘤为多发性骨髓瘤。
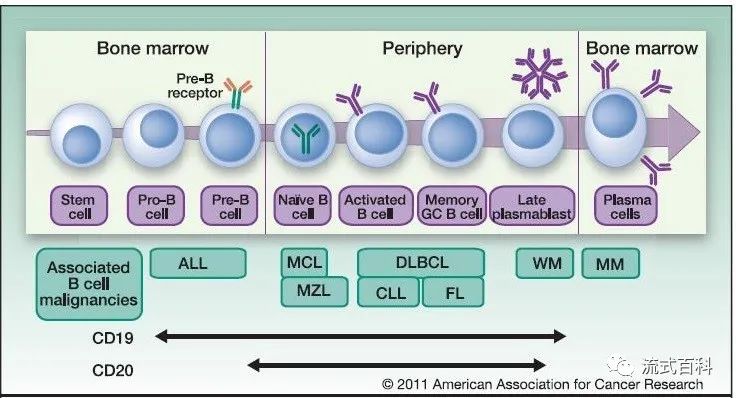
如图中所示:B细胞肿瘤分型依次为:未分化淋巴B细胞白血病→B母细胞白血病(L1)→前B细胞白血病(L2)→高侵袭大B细胞白血病(淋巴瘤)/伯基特白血病(淋巴瘤)→生发中心淋巴瘤/滤泡淋巴瘤/套细胞淋巴瘤→非生发中心(活化)淋巴瘤→浆细胞淋巴瘤/骨髓瘤。
B细胞在肿瘤微环境中起着什么作用呢?是助手还是帮凶?在过去,T细胞对肿瘤免疫监视的作用得到了广泛研究,而对B细胞的研究相对较少。一些研究表明,B细胞可以被视为癌症的一个重要预后因素。B细胞本身可以向CD4+和CD8+T细胞呈递抗原,从而在肿瘤微环境中形成抗原特异性免疫反应。同时,肿瘤浸润性B细胞可能同时发挥促肿瘤和抗肿瘤作用,具体发挥那种机制主要取决于肿瘤微环境的组成、存在的B细胞表型及其产生的抗体。
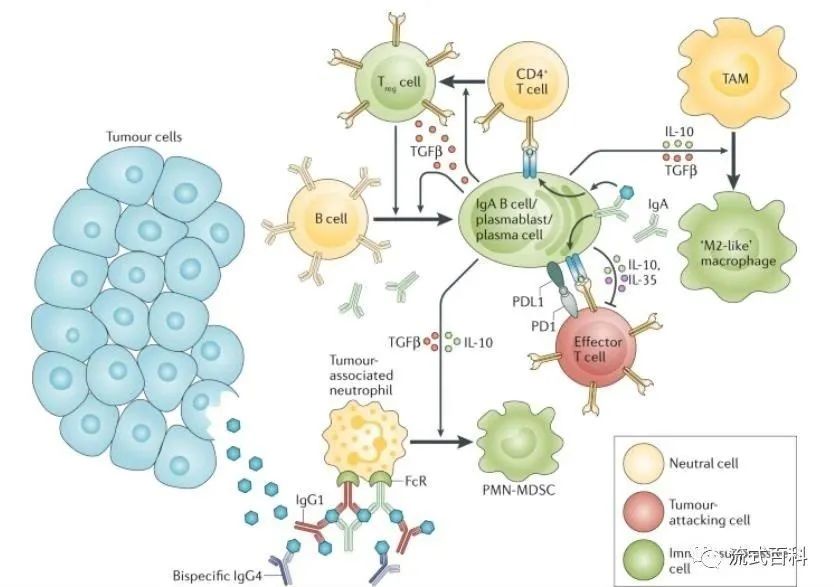
B细胞和浆细胞可能通过多种机制促进肿瘤生长。它们可以释放免疫抑制细胞因子,如IL-10、IL-35和转化生长因子β(TGFβ)等免疫抑制细胞因子,这些细胞因子会促进免疫抑制性细胞的“生成”,比如促进调节性T细胞(Treg )的聚集,或是将肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)向M2型样促肿瘤生长的巨噬细胞样极化,以及将肿瘤相关性嗜中性粒细胞转化为髓样抑制细胞(myeloid-derived suppressor cell, MDSC)。这些细胞因子也会抑制效应T细胞的抗肿瘤反应,B细胞膜上PD-L1的表达也会增强这一抑制效应。除此之外,B细胞也会产生“无效”的抗体,这些抗体不促进抗原呈递,也不介导抗体依赖性细胞毒性作用(ADCC)和吞噬作用杀伤肿瘤细胞。同时这些抗体可以与肿瘤或非肿瘤抗原形成免疫复合物,促进慢性炎症、组织重塑,最终诱导髓系细胞转变为免疫抑制表型。
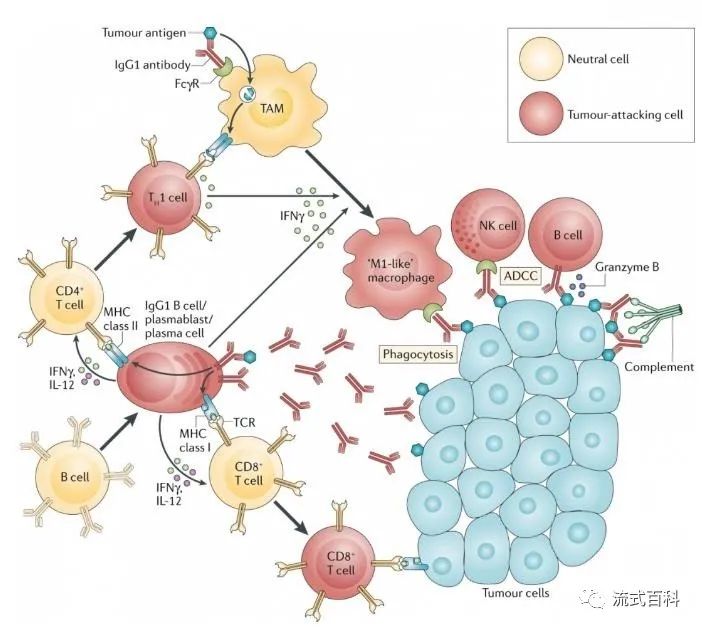
同时,B细胞和浆细胞也可以通过多种机制发挥抗肿瘤免疫效应。浆细胞分泌肿瘤细胞特异性IgG1抗体,其Fc段分别与NK细胞和巨噬细胞表面的FcγR结合,发挥ADCC和吞噬肿瘤细胞的作用。B细胞还参与向CD4+和CD8+ T细胞呈递肿瘤抗原。首先,它们可以通过B细胞受体(BCR)直接提呈捕获的肿瘤相关抗原,然后内化抗原,以便有效将低浓度抗原浓缩和产生响应。最近的研究表明,B细胞可能比DCs更有效地激活T细胞,以便对低浓度的颗粒抗原产生应答。第二,产生的抗体可以支持肿瘤相关巨噬细胞和DCs对肿瘤抗原的摄取。此外,B细胞可能通过释放细胞因子比如IFN-γ和IL-12驱动细胞毒性免疫反应从而促进抗肿瘤免疫。B细胞也可以通过颗粒酶B(granzyme B,GzmB)等直接攻击肿瘤细胞。
通过以上两篇文献,我们可以看出B细胞在肿瘤免疫研究进展中的一正一邪作用,B细胞在肿瘤免疫研究中的机制还尚未清晰,需要我们进一步探索研究。
参考文献: