回顾2022,尽管资本寒冬席卷创新药领域,但是新技术、新疗法的发展并未停下脚步,细胞疗法领域依然蓬勃发展。其中,CAR-T疗法多样化明显出现,新靶点和适应症陆续获批,改善CAR-T疗效的各种新技术也层出不穷。此外,行业对NK细胞这种通用现货型药物平台也充满期待,新成立的细胞药物研发公司大多数选择NK细胞作为平台技术,进军CAR-NK领域。展望2023,医药魔方综合过去一年细胞疗法领域交易合作/投融资、重大进展、技术特色等,筛选了10家值得关注的细胞疗法公司,以供参考。
核心技术:下一代自体和同种异体CAR-T
2022动向:与罗氏达成超60亿美元的合作+ 增发8050万美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://poseida.com/
Poseida Therapeutics是一家总部位于美国圣地亚哥的临床阶段生物制药公司,致力于利用专有的基因工程平台技术来创造具有治愈能力的下一代细胞和基因疗法,并且由自体逐渐转向同种异体CAR-T疗法。
该公司的CAR-T细胞不含有单链可变片段(scFv)结构,而是由全人源的Centyrin结构域组成。Centyrin是一种小型、简单、高度稳定的蛋白质,能以很高的特异性和亲和力结合目标抗原,在稳定性高的同时具有低免疫原性。
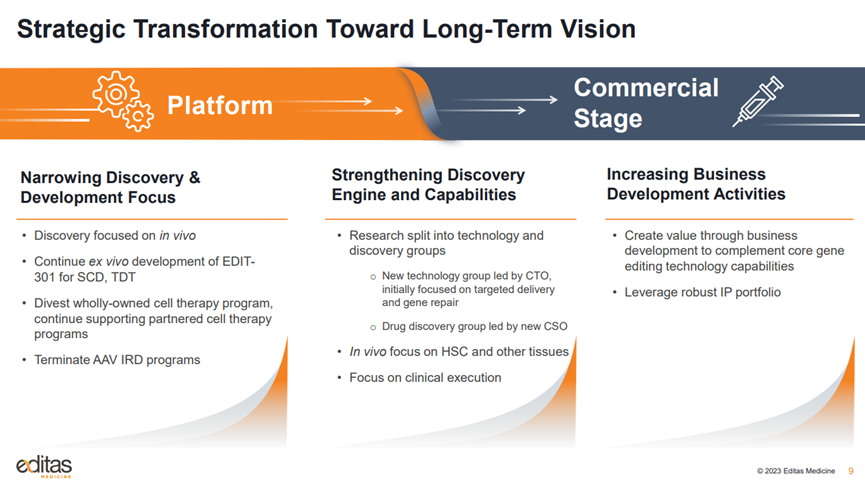
不同于传统的病毒载体系统,Poseida专有的piggyBac DNA修饰系统使用非病毒载体将CAR分子基因递送给T细胞,可以产生具有高百分比T记忆干细胞(TSCM细胞)的CAR-T产物。TSCM细胞具有自我更新能力和多能性,高TSCM细胞占比可以使候选药物更有效、毒性更小、更耐用;非病毒载体制造成本低、生产时间短、诱变和肿瘤发生的风险低;同时,PiggyBac的载货量可达慢病毒载体的20倍,可以有效递送超大片段基因,实现稳定的转基因表达。
 来源:Poseida官网
来源:Poseida官网
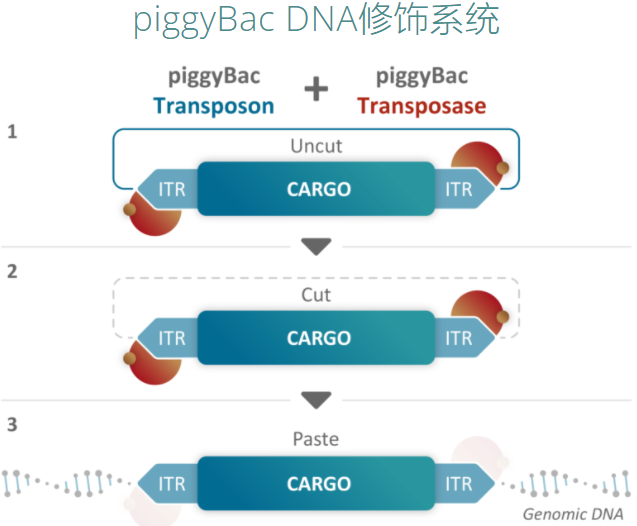
此外,Poseida使用Cas-CLOVER系统敲除CAR-T细胞中多种T细胞关键抑制信号的受体,可以保证CAR-T细胞的活化状态。Cas-CLOVER使用了一种被称为dCas9的Cas9酶,这种酶无法切割DNA,只有在与适当的引导RNA结合时才起到DNA 结合蛋白的作用。该系统能有效的避免TALEN技术只能用于激活的细胞的使用限制性和CRISPR/Cas9可能的脱靶突变带来的潜在安全风险。
 来源:Poseida官网
来源:Poseida官网
综合来看,Poseida的在研产品旨在解决其他CAR-T疗法的局限性,包括反应持续时间、治疗实体肿瘤的能力和安全性问题,其转染、编辑以及递送平台都有独特优势,可能带来成本更低、生产时间更短的CAR-T疗法,解决当下的瓶颈。
该公司的技术平台也得到了大药企的认可:2021年10月,与武田就新型非病毒体内基因疗法开展高达36亿美元的研究合作;2022年8月,Poseida宣布与罗氏达成总额超60亿美元的全球战略合作与许可协议,这也是2022年细胞疗法领域金额最高的“License in”交易。罗氏将从Poseida获得独家授权,对Poseida产品组合中针对血液恶性肿瘤的一些同种异体CAR-T项目进行开发和商业化。在与罗氏合作的消息发布之后,Poseida的股价暴涨了85%。
核心技术:“可控”自体和同种异体CAR-T
2022动向:与吉利德旗下Kite达成潜在总额超40亿美元合作 + IPO 1.423亿美元 + 增发1.288亿美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://www.arcellx.com/
总部位于美国马里兰州的Arcellx致力于开发更安全、更有效、更广泛的创新免疫疗法,以治疗癌症和其它无法治愈的疾病。
2022年2月8日,公司宣布完成IPO,此次发行的总收益为1.423亿美元。所获资金将用于推动其主打CAR-T疗法(CART-ddBCMA)进入关键性临床试验,治疗复发/难治性多发性骨髓瘤(r/r MM),以及推动其“可控”CAR-T在研疗法进入临床开发阶段。CART-ddBCMA已获FDA授予的快速通道资格、先进再生医学疗法认定,和孤儿药资格。IPO前Arcellx累计融资超2亿美元。
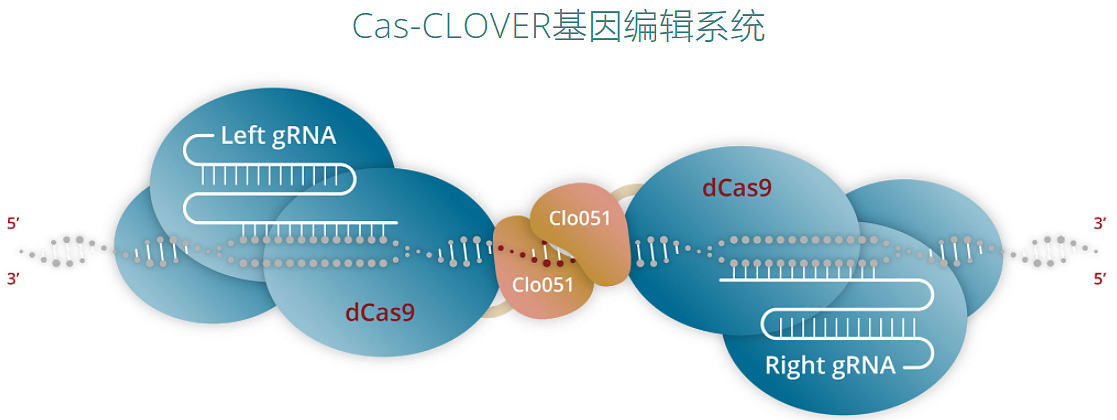
鉴于现有的细胞治疗方案大多使用基于生物的scFv结合域,往往只对有限的部分患者有益,还常常导致高毒性,并且在可治疗适应症中的适用性狭窄。Arcellx通过设计一类新的D-Domain驱动的自体和同种异体CAR-T细胞来克服这些限制,包括经典的单次输注CAR-T(称为ddCARs)和可剂量控制的通用型CAR-T(称为ARC-SparX)。
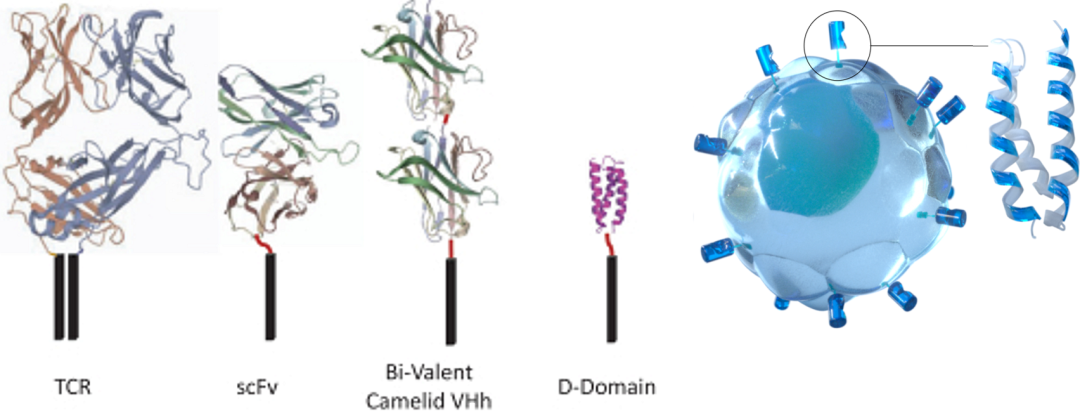 D-Domain是一种小型、稳定、全合成的接合剂,具有疏水核。当用于CAR时,其独特的结构可能实现更高的转导效率、更高细胞表面表达和更低的强直信号传导,其设计目的是提高靶标特异性,同时增强结合亲和力。D-Domain的独特性允许生成专有靶标结合域的多样库,并作为Arcellx专有的ddCAR和ARC-SparX平台的基础。(来源:Arcellx招股书和官网)
D-Domain是一种小型、稳定、全合成的接合剂,具有疏水核。当用于CAR时,其独特的结构可能实现更高的转导效率、更高细胞表面表达和更低的强直信号传导,其设计目的是提高靶标特异性,同时增强结合亲和力。D-Domain的独特性允许生成专有靶标结合域的多样库,并作为Arcellx专有的ddCAR和ARC-SparX平台的基础。(来源:Arcellx招股书和官网)
2022年12月9日,Arcellx公布了CART-ddBCMA在r/r MM中的I期临床试验数据,患者ORR达到100%,38例可评估患者中27例(71%)达到CR或sCR,34例(89%)达到非常好的部分缓解(VGPR)以上的缓解。同一日,吉利德科学旗下Kite宣布与Arcellx达成潜在总额超40亿美元的研发合作协议,将共同开发和商业化Arcellx的临床后期在研疗法CART-ddBCMA,用于治疗r/r MM患者。
核心技术:iPSC衍生的CAR-iNK和CAR-iT细胞疗法
2022动向:与百时美施贵宝达成超30亿美元合作+增发5000万美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://www.centurytherapeutics.com/
Century Therapeutics成立于2018年,总部位于美国费城,是一家面向新兴的即用型同种异体细胞疗法领域,专注于同种异体、诱导多能干细胞(iPSC)衍生的CAR-iNK和CAR-iT细胞疗法的创新生物技术公司。
2019年7月1日,Century走出隐身模式,获得了来自拜耳、Versant以及富士胶片株式会社子公司FCDI高达2.5亿美元的融资,用于推进其多项血液肿瘤和恶性实体瘤研究进入临床阶段。2021年3月,Century宣布完成1.6亿美元的C轮融资;6月,公司在纳斯达克正式上市,拟募资2.11亿美元。2022年1月,Century与百时美施贵宝(BMS)达成一项总额超30亿美元的研究合作和许可协议,以联合开发和商业化iPSC衍生的同种异体细胞疗法,计划用于治疗血液系统恶性肿瘤和实体瘤。
Century在iPSC衍生疗法领域的大步向前离不开其技术平台的5个关键要素:
1)高效精准的基因编辑技术:提高基因组精确性与完整性;
2)专有的ALLO-EVASION™技术:降低患者免疫排斥,有望重复给药;
3)CAR与蛋白质编辑:针对肿瘤异质性和抗原缺失问题;
4)通用型工程化iPSC前体:其无限自我更新能力的iPSC技术能够降低新产品开发的设计投入,加速候选产品研发的迭代;
5)简化的制造过程。
目前,公司正在整合一系列同种异体iNK和iT细胞治疗产品候选产品,涵盖实体瘤和血液系统恶性肿瘤。所有候选产品均采用专有的Allo-Evasion™技术,以避免宿主排斥反应,并可能提高临床应答的持久性。
 Century在研管线(来源:Century官网)
Century在研管线(来源:Century官网)
其中主要候选产品CNTY-101为iPSC来源的通用型CAR-iNK疗法,被改造表达CD19 CAR、可溶性IL-15与EGFR安全开关。具体来说:1)使用Allo-Evasion™技术删除β2M以消除HLA-1的表达,防止自体T细胞杀伤;加入HLA-E表达,以结合NKG2A,防止自体NK细胞杀伤;2)纳入稳态细胞因子IL-15,增加持久性和功能性;3)安全开关可允许通过注射西妥昔单抗的ADCC作用抹除表达EGFR的细胞,旨在必要时在体内快速清除细胞。
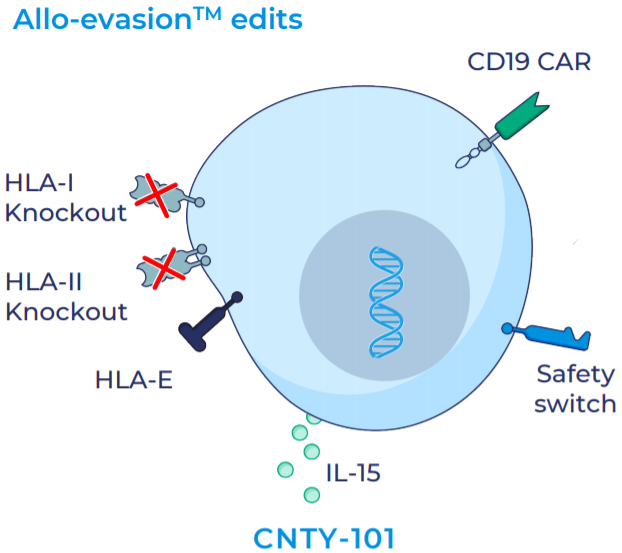 CNTY-101结构示意图(来源:Century)
CNTY-101结构示意图(来源:Century)
2022年8月25日, Century宣布美国FDA已批准CNTY-101的IND申请,用于复发/难治性B细胞恶性肿瘤的治疗。
核心技术: CAR-γδ T细胞疗法;TCR-γδ T细胞疗法
2022动向:与BMS达成超14亿美元合作 + 与 Editas Medicine达成未披露金额的合作
魔方评分:⭐⭐⭐⭐
公司官网:https://immatics.com/
Immatics成立于2000年,孵化自德国Tübingen大学的H.G. Rammensee实验室,是一家活跃于发现和开发T细胞重定向癌症免疫疗法的生物技术公司,专注于免疫治疗药物的发现。
基于其独特的靶点(XPRESIDENT®平台)和T细胞受体(XCEPTOR®平台)发现能力,Immatics开发了广泛而多样的癌症免疫治疗组合,建立了包括ACTengine®(自体)、ACTallo®(异体)、TCER®(双特异性)方法为基础的T细胞疗法。
ACTengine®是一种个性化TCR-T疗法,患者自身的T细胞经过基因修饰,以表达新的专有TCR,然后将修饰的T细胞重新注入患者体内,以与肿瘤特异性结合。
ACTallo®是γδT细胞衍生的同种异体“现货型”细胞疗法。
TCER®是一种工程化“现货型”生物制剂,旨在结合患者的循环T细胞,并将其带到癌细胞附近并加以摧毁。其由一个直接识别癌细胞的TCR和一个招募及激活患者T细胞的T细胞招募域组成。
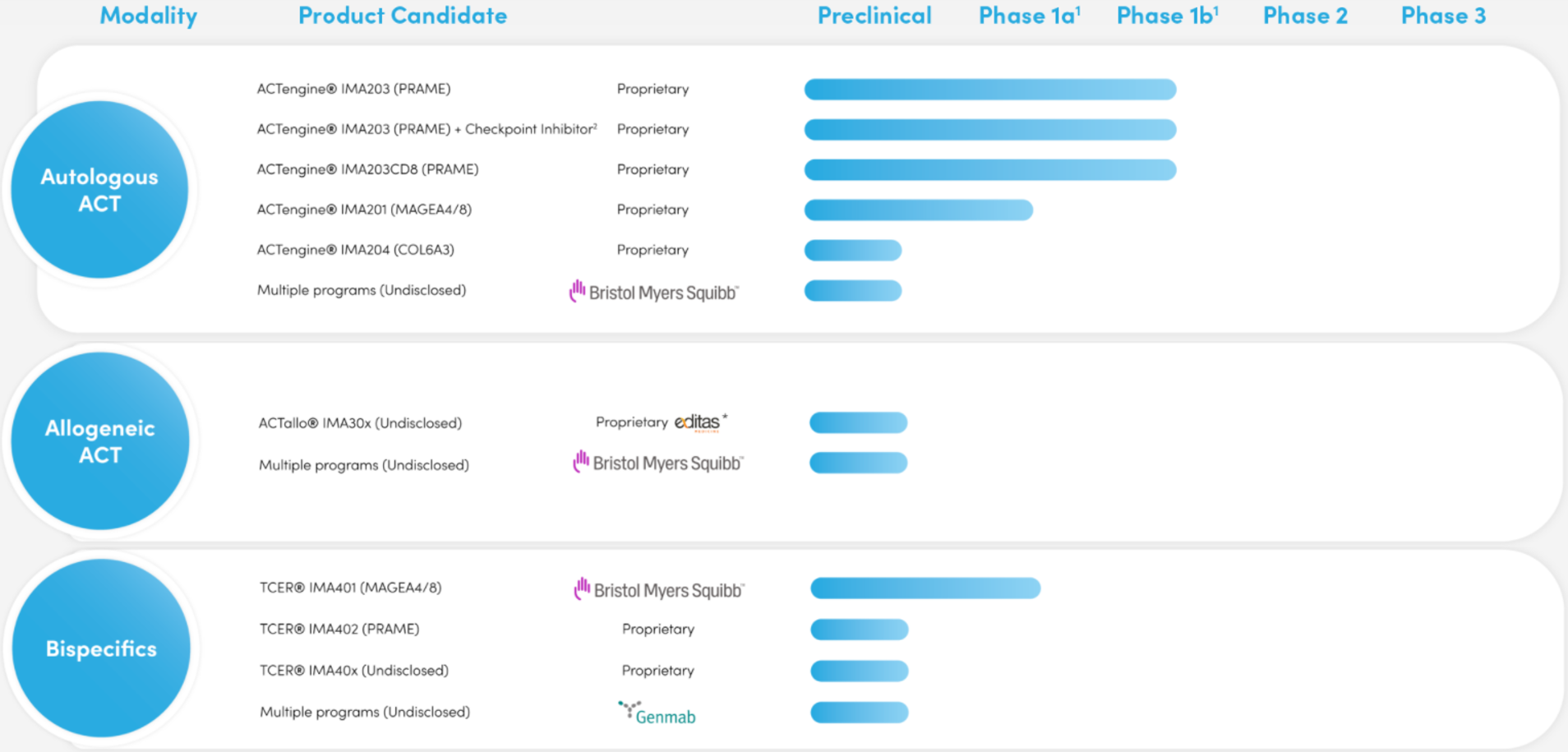 Immatic在研管线(来源:Immatic官网)
Immatic在研管线(来源:Immatic官网)
2022年10月10日,Immatics公布了其TCR-T疗法ACTengine® IMA203的积极中期数据,在Ib期临床试验部分,接受治疗的5例患者中有4例(80%)获得确认客观缓解。根据初步结果,公司同时宣布了一项新的公开募股,融资1.1亿美元。
事实上,Immatics是TCR-T领域的吸金王,曾受到了各大制药巨头青睐。近年来其与Genmab(5.5亿美元)、Amgen(13 亿美元)、 Roche(10亿美元)、Celgene(15.9亿美元)、GSK(10亿美元)、BMS(9.2亿美元)等多家合作伙伴联合开发过继细胞疗法和双特异性抗体。
2022年6月2日,Immatics与BMS共同宣布,双方扩大战略联盟以开发多种同种异体现货型TCR-T和/或CAR-T项目。本次合作总额超14亿美元。同月7日,Immatics又与CRISPR基因编辑技术奠基人之一张锋创立的Editas Medicine共同宣布,两家公司已达成战略研究合作和许可协议,将γδT 细胞过继细胞疗法和基因编辑相结合,以开发用于治疗癌症的药物。
核心技术:基于 CRISPR 基因编辑的 NK 细胞疗法
2022动向:与赛诺菲达成10.25亿美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://www.scribetx.com/
Scribe总部位于美国加利福尼亚州,由CRISPR发明者以及领先的分子工程师Jennifer Doudna、Benjamin Oakes、Brett Staahl、David Savage共同创立,专注于为基于CRISPR的基因医学设计最先进平台。公司已累计完成1.2亿美元融资。
CRISPR是细菌和病毒进行斗争产生的免疫武器,可以在细菌中进化为“基因破坏”形式,以抵御病原体。它在细菌中非常有效,但当研究人员试图将其用于人类时会遇到各种障碍。例如,对于体内编辑,Cas9的大小使其不适合用于体内基因编辑疗法递送的腺相关病毒(AAV)。
Scribe的X-editing (XE)技术是一项以创新CasX酶为基础的系统。2019年,Jennifer Doudna团队在Nature上发表论文,证实了其于2016年发现的新型Cas蛋白——CasX可以用于基因组编辑,并揭示了新型基因组编辑工具CRISPR/CasX的潜在机制,该工具使用独特的结构进行可编程的双链DNA结合和切割。CasX最重要的应用特点在于其比Cas9、Cas12a都要小得多,只有不到1000个氨基酸,可被包裹在AAV载体中。CasX不仅小巧,还具有独特的可编程编辑方式,具备先前CRISPR-Cas基因组编辑技术缺乏的优势。
Scribe目前共有5个研发方向,包括:
神经系统疾病(亨廷顿舞蹈症、家族性渐冻症、脊髓性肌萎缩症、帕金森病、早发性家族性阿尔茨海默症、天使综合征等);
眼科疾病(色素性视网膜炎、视锥-视杆细胞营养不良、先天性黑蒙症、青光眼、全色盲等);
多系统、肌肉和代谢疾病(囊性纤维化、杜氏肌营养不良、α1-抗胰蛋白酶缺乏症、早衰症、家族性高胆固醇血症、苯丙酮尿症等);
造血功能障碍疾病(镰状细胞病、重度联合免疫缺陷、范可尼贫血、血友病A/B、慢性肉芽肿、血管性血友病);
细胞疗法(CAR-T、NK、TiL、HSC、iPSC)。
 来源:Scribe Therapeutics官网
来源:Scribe Therapeutics官网
近年来,Scribe已先后与制药巨头渤健、赛诺菲达成战略合作。2022年9月27日,赛诺菲宣布与 Scribe达成超10亿美元的合作,开发基于 CRISPR 基因编辑的 NK 细胞疗法来对抗癌症。在此之前(2020年10月),Scribe 曾与渤健达成超4亿美元合作,共同开发基于CRISPR的疗法,以解决导致肌萎缩性侧索硬化症(ALS)的潜在遗传病因。
核心技术: 通用型CAR-NK细胞疗法
2022动向:增发2.3亿美元+公布了两款CAR-NK在研产品的积极初步临床数据
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://www.nkartatx.com/
Nkarta Therapeutics成立于2015年,是一家专注于开发同种异体现货型NK细胞疗法用于癌症治疗的临床阶段生物制药公司。2020年7月10日,Nkarta登陆纳斯达克拟募集资金2.52亿美元。上市前,该公司累计完成了1.25亿美元融资。
Nkarta公司专有的NK细胞治疗平台旨在通过增强靶向性、大量的扩增和延长这些免疫细胞的持久性,最大限度地提高NK细胞的治疗效果,从而释放出强大而持久的抗癌免疫介导攻击。
为了提高NK细胞的抗肿瘤活性,一般会系统输注临床级的重组IL2或者单链IL15细胞因子,然而,这种方法往往伴随严重的不良反应,且IL2输注往往同时导致抑制性免疫细胞Treg的扩增,抑制NK细胞的活性。因此,NK细胞临床试验多使用IL15。Nkarta公司通过基因工程的方法,使外周血NK细胞表达膜结合的IL15(mbIL15),提高了NK细胞的存活、增殖、杀伤能力。
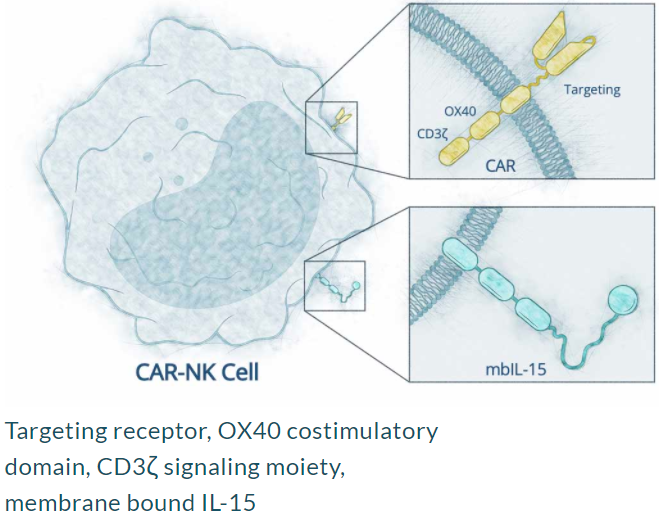 Nkarta公司设计的CAR-NK(来源:Nkarta官网)
Nkarta公司设计的CAR-NK(来源:Nkarta官网)
2022年4月,Nkarta公布了两款CAR-NK在研产品:靶向NKG2D的NKX101和靶向CD19的NKX019治疗血液瘤的积极初步临床数据。NKX019治疗复发/难治性非霍奇金淋巴瘤(r/r NHL) 患者,高剂量组6例中5例(83%)获得了缓解(ORR),其中3例(50%)获得了完全缓解(CR)。受此消息影响,该公司股价上涨140%。2022年12月,该公司又公布NKX019作为单药治疗 r/r NHL 患者的I期 积极研究结果,较高剂量水平治疗组CR达70%,再振人心。
2022年4月28日,Nkarta宣布完成增发的2.3亿美元融资,并拟将这笔收益用于资助 NKX101和 NKX019的临床开发、研究阶段项目的临床前研究以及内部制造能力的持续建设。
核心技术:逻辑门控CAR-T
2022动向:B轮融资2.2亿美元+与BMS、罗氏建立合作
魔方评分:⭐⭐⭐⭐
公司官网:https://www.arsenalbio.com/
Arsenal Biosciences成立于2019年,专注于整合基于CRISPR的基因编辑、规模化高通量靶点识别、合成生物学和机器学习等技术,以推进免疫细胞疗法的发现和开发新范式。该公司正在构建行业中最大型的治疗增强整合回路文库,利用逻辑门控改善肿瘤靶向,并且通过合成生物学让CAR-T疗法具有行使多种药物功能的潜力。
2022年9月,Arsenal完成2.2亿美元B轮融资,目前累计融资金额超3亿美元。此外,2022年其与跨国制药巨头也达成了两项合作:1月,Arsenal宣布扩大与BMS的战略合作,以发现和推进用于治疗实体瘤的T细胞疗法;9月,Arsenal与罗氏旗下基因泰克达成7000万美元合作协议, 运用Arsenal专有科技进行高通量筛选与T细胞工程化,以识别T细胞类疗法成功的关键枢纽,开发未来实体瘤疗法。
公司联合创始人之一,加州大学旧金山分校的Kole Roybal教授,凭借其开发的全新T细胞免疫疗法成为2018年首届Sartorius & Science Prize for Regenerative Medicine & Cell Therapy大奖得主。2021年其在Science Translational Medicine发表的几篇论文指出,名为synNotch的调控系统能够提高CAR-T细胞靶向特异性,提高细胞疗法的持久性。
 Kole Roybal教授(来源:Arsenal官网)
Kole Roybal教授(来源:Arsenal官网)
值得一提的是,Arsenal也上榜了由生物医药行业知名媒体网站BioSpace评选的2021年度新一代(NextGen)生物新锐公司。入选公司皆在近几年成立,BioSpace通过对公司资本助力、合作、研发管线、成长潜力以及创新方面进行综合评估。Arsenal的入选也体现其短短几年内对业界产生了重大影响。
核心技术:基于合成生物学开关技术的TCR-T
2022动向:1.75亿美元的A轮融资 + 与Metagenomi建立合作 + 入围“Most Promising Biotech Startups of 2022”榜单
魔方评分:⭐⭐⭐⭐
公司官网:https://www.affinittx.com/
Affini-T Therapeutics是一家专注于T细胞免疫疗法的初创公司,成立于2021年,总部位于波士顿。公司致力于通过调节免疫系统来靶向致癌驱动突变,为难治性实体瘤患者开发可能改善生活的药物。公司创始团队及科学顾问委员会阵容豪华,包括Fred Hutchinson癌症研究中心免疫学负责人、癌症免疫治疗专家Phil Greenberg博士,癌症免疫疗法先驱、诺贝尔生理学或医学奖得主Jim Allison教授,知名癌症免疫疗法转化科学家Pam Sharma教授等。
Affini-T的基础细胞疗法平台建立在创始团队开创性工作的基础上,旨在利用T细胞受体(TCR)发现引擎和一套合成生物学组件,开发靶向KRAS和p53等致癌驱动突变的潜在best-in-class疗法。
具体来说,该公司团队利用先进的合成生物学和基因编辑技术,开创性地设计TCR-T细胞疗法以靶向致癌驱动突变。公司的TCR发现平台是一个强大的引擎,可用于识别罕见的高亲和力TCR,在实体瘤中释放免疫应答。此外,Affini-T利用专有的合成生物学开关受体来重编程免疫细胞,可显著改善T细胞在敌对肿瘤微环境中的增殖存活以及持久反应的能力。
 Affini-T的技术通过协调CD4/CD8的协同反应,引发更深入和显著的抗肿瘤效应。(来源:Affini-T官网)
Affini-T的技术通过协调CD4/CD8的协同反应,引发更深入和显著的抗肿瘤效应。(来源:Affini-T官网)
核心技术: 基于基因回路技术的同种异体CAR-NK
2022动向:与 DYNS 合并业务并上市,预计总收益约为 1.565 亿美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://www.sentibio.com/
Senti Biosciences是一家利用利用合成生物学设计“基因回路”以改善细胞和基因治疗产品 的初创公司,出道即自带 “光环”,由合成生物学奠基人James J. Collins及其学生卢冠达等于2016年联合创办。公司使命是用更智能的药物来战胜复杂的疾病,从而改变人们的生活。在宣布合并上市前,Senti Bio累计完成了约2亿美元的融资。
Senti Bio的基因回路是一种新颖的、专有的DNA组合,使细胞能够感知环境、执行逻辑并指导细胞产生治疗性蛋白质,从而提高安全性和疗效。该公司相信,其在活细胞中编程基因回路的方法可以使药物开发者在几乎任何细胞或基因药物中构建最佳功能。公司专有平台包括特定的基因回路技术,如逻辑门、小分子调节器、组合有效载荷和合成启动子,这些技术有可能赋予细胞和基因治疗产品更高的疗效、精确度和控制能力。
Senti Bio的肿瘤学管线主要专注于3个临床前阶段项目:SENTI-202,一种逻辑门控(OR+NOT)现货型CAR-NK细胞疗法,旨在靶向和消除急性髓系白血病(AML)细胞,同时避免损伤健康骨髓;SENTI-301,一种可调节的多臂现货型CAR-NK细胞疗法,用于治疗肝细胞癌(HCC);SENTI-401,一种逻辑门控(NOT)现货型CAR-NK细胞疗法,旨在靶向和消除结直肠癌(CRC)细胞,同时避免损伤其他部位的健康细胞。此外,该公司还与罗氏子公司Spark Therapeutics 和拜耳子公司 BlueRock Therapeutics合作,将其基因回路技术应用于肿瘤学以外的领域。
2021年 12 月底,Senti Bio宣布与 DYNS 的SPAC 合并协议,预计合并总收益预计将超 2.96 亿美元。当时公告指出,双方的合并交易已获得 DYNS 和 Senti Bio 董事会的批准,预计合并的时间为 2022 年第二季度。2022年6月,Senti Bio与SPAC 合并上市交易如期完成,预计总收益约为 1.565 亿美元 。
核心技术:靶向实体瘤CAR-T
2022动向:B轮融资超1.2亿美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://www.oricell.com/
原启生物成立于2015年,在2019年底获得启明创投近亿元的Pre-A轮独家投资后,作为生物创新药研发资产从原能细胞集团剥离,开始以创新型细胞治疗技术平台为核心,聚焦于肿瘤免疫治疗领域的产品开发。
2022年3月, 原启生物宣布任命原复星凯特CTO崔卫东博士为首席技术官,负责公司工艺开发及生产,加速推动公司靶向实体瘤的CAR-T产品临床注册及未来商业化进展。8月,原启生物宣布完成总金额超过1.2亿美元的B轮融资,资金将主要用于推进公司十余条经过充分概念验证(POC)的肿瘤细胞治疗产品管线的开发和商业化进程,继续完善公司自主创新技术平台的建设,以及未来商业化生产基地的规划与建设。
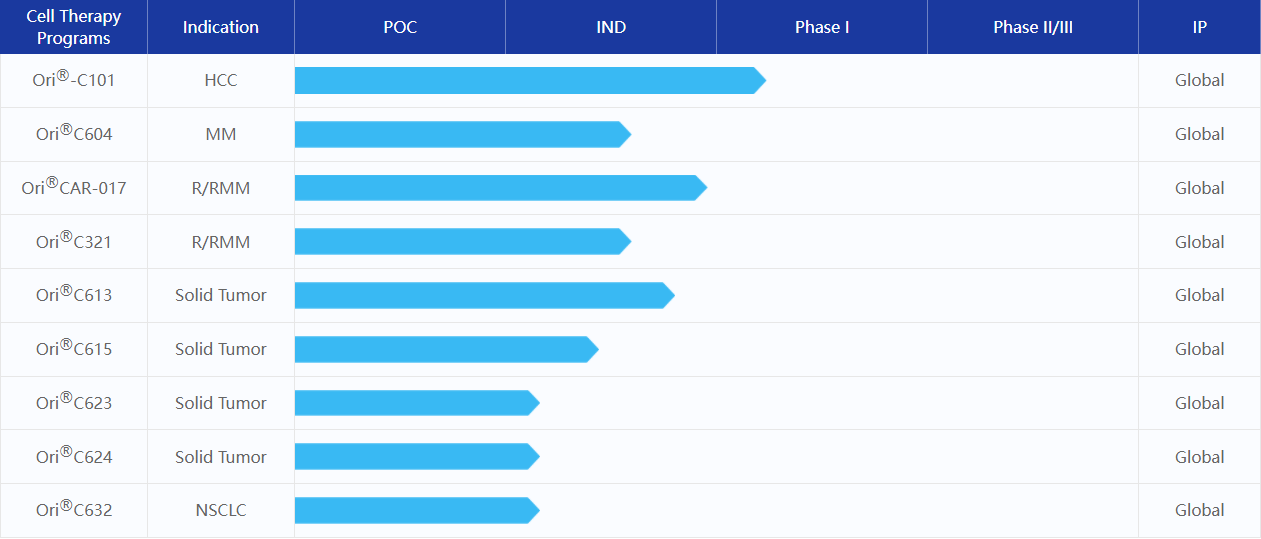 原启生物CAR-T产品管线(来源:原启生物官网)
原启生物CAR-T产品管线(来源:原启生物官网)
在产品研发进展方面,公司首个自主开发靶向GPC3治疗晚期肝癌的CAR-T产品(Ori-C101)的临床试验申请(IND)获得了国家食品药品监督管理局药品审评中心(CDE)的受理。在过往的临床研究中,Ori-C101已经在GPC3阳性晚期肝癌患者中表现出良好安全性和有效性。
原启生物开发的中国首款GPRC5D CAR-T产品OriCAR-017 用于治疗r/r MM,其研究者发起的I期临床试验(POLARIS)充分证实了该产品极大的开发前景。原启生物以口头报告形式分别在2022 ASCO、2022 EHA年会上公布了截止至2022年4月30日的临床结果。数据显示,包括5例既往BCMA CAR-T治疗失败的受试者在内的所有受试者,均获得100%客观缓解率(ORR)和100%微小残留病灶(MRD)阴性率,持续无进展,无需任何额外抗肿瘤治疗以及良好的安全性。目前,原启生物正加快推进其中美两地的注册及临床开发速度。
核心技术:下一代自体和同种异体CAR-T
2022动向:与罗氏达成超60亿美元的合作+ 增发8050万美元
魔方评分:⭐⭐⭐⭐⭐
公司官网:https://poseida.com/

2023年第41届摩根大通医疗保健会议(JPM)正式恢复线下召开。
在第一天的报告出现了不少细胞与基因治疗的公司,有不少公司都带来了自己对2023年的积极展望,例如手握潜在首款DMD基因疗法的Serepta公司、首款治疗血友病A的获批基因疗法的BioMarin等;也有目前在监管问题中挣扎的一些公司:例如遭FDA临床暂停的Beam、裁员换血的Editas等。
bioSeedin将聚焦于Day 1 中的细胞与基因疗法部分,对其公开的报告进行整理与综合。
在周一上午的演讲中,诺华首席执行官Vas Narasimhan表示:公司的 2023 年战略侧重于五个治疗领域:心血管、免疫学、神经科学、实体瘤和血液学。
Narasimhan说,该公司计划在这些领域取得进展的方式之一是通过其基因治疗产品组合,并且表示诺华“内部有超过15个项目正在继续推进”。
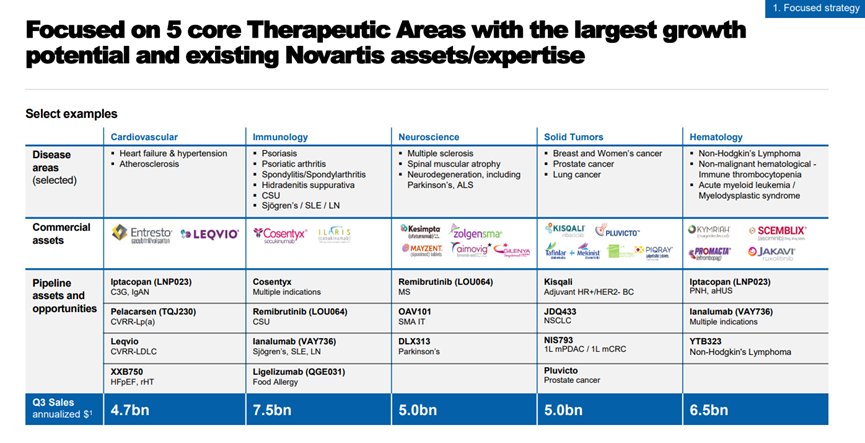
在免疫学方面,Narasimhan表示,诺华将使用其T-Charge平台将把大部分精力集中在细胞和基因治疗上。
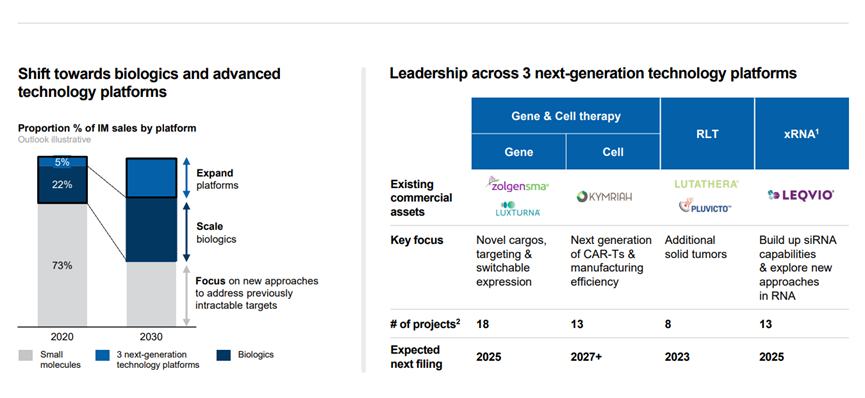
此外,诺华还特别指出了近期即将要公布临床试验读数的关键资产。

中午 12:12,Prime Medicine首席执行官Keith Gottesdiener在JPM23会议上发表演讲。Prime Medicine是刘如谦参与创立的第3家上市公司,专注于使用Prime Editing 技术进行基因编辑。

Keith提到近期基因疗法在FDA的屡屡碰壁,表示这些都是“成长的痛苦”,可能会在未来几年内得到解决。与此同时,他表示Prime公司拥有“强大的现金跑道”,暂时不担心资金问题。
Prime 有 18 个项目正在开发中,不过都处于非常早期的阶段。
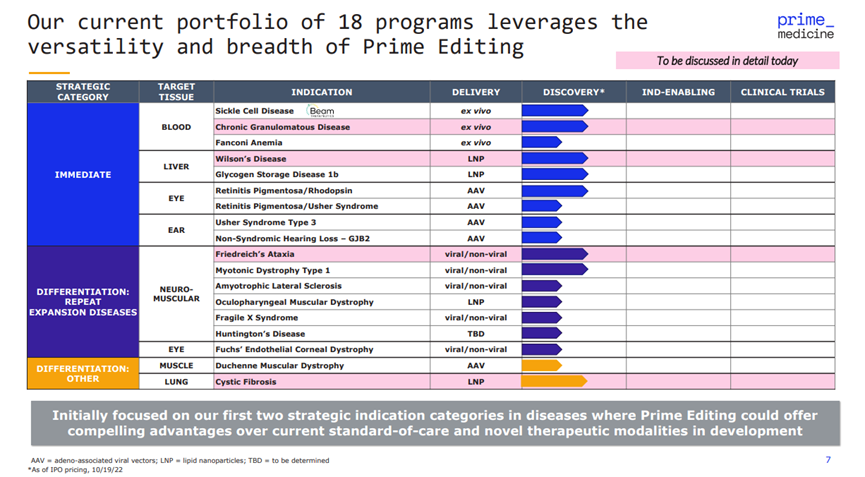
Keith表示,2023年,公司将着重寻找BD交易与外部合作的机会。
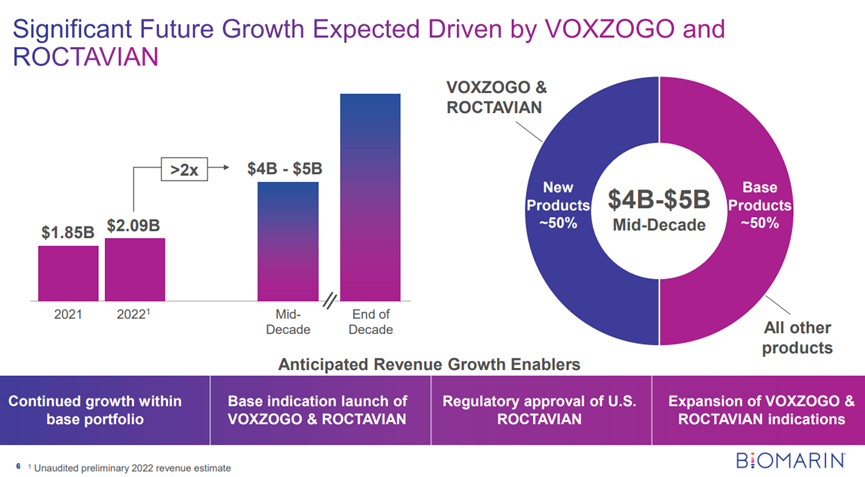
下午 12:51,BioMarin董事长兼首席执行官J.J. Bienaimé发表演讲,称其基因治疗产品Roctavian为迄今为止“最强劲的产品”。

Roctavian是一款治疗严重血友病A的基因疗法,使用AAV5病毒载体递送表达凝血因子VIII的转基因。今年8月24日,欧盟委员会(EC)批准此基因疗法有条件上市,成为首款用于治疗血友病A的基因疗法。
近日,BioMarin公司宣布了Roctavian取得3期临床的积极结果,该试验的随访时间超过了3年。这是目前规模最大,持续时间最长的血友病基因疗法全球3期临床试验。

试验结果显示,在治疗3年和4年的患者中,其凝血因子VIII的活性平均值分别为18.8和15.2,中位数值为8.4和7.4。两组的平均年出血事件率分别为1.0和0.8,而中位值都为0.0。此外,两组的年凝血因子平均使用次数分别为8.4和11.1,中位值也均为0。与基线值相比,在治疗的第三年后,患者的平均年出血事件率减少了80%,而凝血因子VIII的使用减少了94%。
Bienaimé表示,他预计超过75%的美国处方者将在上市后一年内采用Roctavian来治疗严重的成人血友病A患者。加上Voxzogo,一种用于增加软骨发育不全儿童(5岁及以上)线性生长的疗法,Bienaimé预测到十年中期BioMarin的增长将达到40亿至50亿美元。
下午 1:30,Sarepta Therapeutics总裁兼首席执行官Doug Ingram发表报告。

11月,FDA接受了Sarepta 公司的BLA申请,如果获得批准,SRP-9001将成为市场上第一个针对杜氏肌营养不良(DMD)的基因疗法。FDA已将PDUFA日期定为2023年5月29日。
SRP-9001是通过AAV将编码微肌营养不良蛋白的基因传递到肌肉组织,使肌肉细胞表达对应的蛋白,从而减缓或阻止肌肉退化。
该疗法采用从非人灵长类动物中分离出的AAVrh74病毒载体,此病毒载体优点是能够在肌肉中引起转基因的强力表达,不会穿过血脑屏障进入中枢神经系统,且较少患者体内存在针对这一病毒载体的中和抗体。
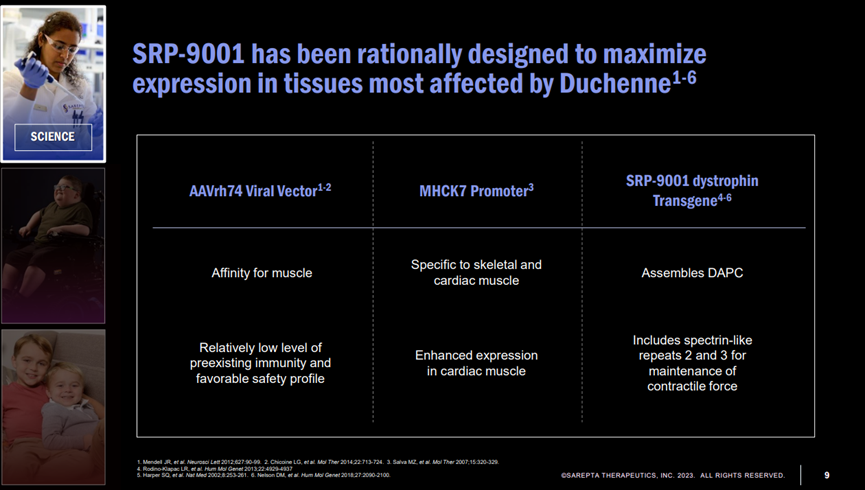
Doug Ingram在大会上公布了相关数据,其中包括临床前动物模型,功能数据和生物标志物等,大量临床前和临床数据支持SRP-9001的疗效。

下午4:47,Beam Therapeutics公司发表演讲,该公司密切关注关注镰状细胞疗法的市场。

Beam 公司报告了公司血液学,免疫肿瘤学和遗传疾病产品组合的进展,并提供了预期即将到来的里程碑的最新情况。

第三季度财报中,Beam Therapeutics表示将停止对BEAM-102的IND申请进程。BEAM-102用于治疗镰状细胞病,通过直接编辑导致病变的血红蛋白S点突变来重建正常的人类血红蛋白。
今年7月,FDA暂停了其CAR-T 疗法BEAM-201的IND申请,后又得到解除。BEAM-201针对CD7靶点,是首个同时针对4个基因展开编辑的CAR-T疗法。
下基因编辑公司Editas Medicine在JPM宣布了重要战略更新,包括投资组合重新确定优先级和研发调整。该公司由张锋、刘如谦共同创立,于2016年上市,是全球CRISPR基因编辑领域首家IPO的公司。

Editas表示,将停止对遗传性视网膜疾病和临床前全资拥有的iNK项目的内部投资,专注于血红蛋白病和体内基因编辑。公司将资源优先分配给EDIT-301,该项目用于治疗严重镰状细胞病和输血依赖性β地中海贫血。
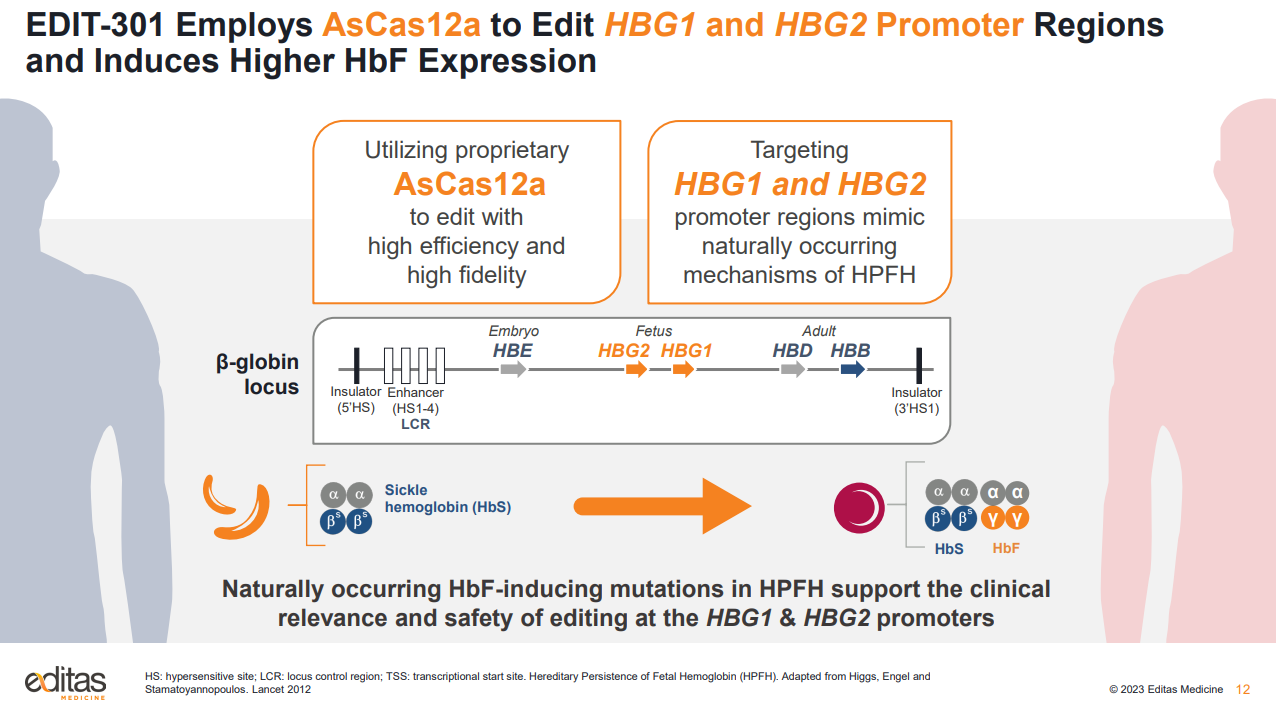
Editas希望为遗传性眼病项目EDIT-101和EDIT-103寻找外部合作伙伴,但会继续开发合作研发的细胞疗法项目。
Editas裁员了20%,预计将把公司的现金跑道延长到2025年。此外,首席科学官Mark S. Shearman博士将从2023年3月31日起离开公司。