
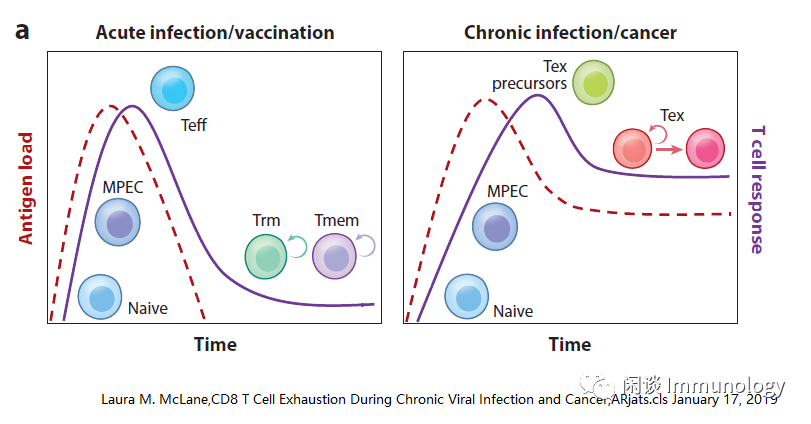
急性感染和疫苗接种后,T细胞向效应T细胞(Teff)和记忆T细胞(Tmem)分化。
慢性感染和癌症病人,T细胞受到抗原持续刺激,细胞记忆不能有效地发育分化,T细胞变得精疲力竭,称之为T细胞耗竭(Tex)。
Tex细胞在功能上有别于Teff和Tmem,其特点是效应功能丧失,抑制性受体(IRS)表达增高且持续,表观遗传和转录谱改变,代谢方式改变。
T细胞衰竭是癌症病人免疫功能障碍主要因素之一。
细胞因子产生缺陷,早期:IL-2和TNF产生缺陷。衰竭期:IFN-γ产生缺陷。
可能保留产生趋化因子的能力,包括MIP-1α,MIP-1β,和RANTES等
一般来说,Tex细胞效应功能丧失因疾病而异,与病原体负荷、病原体复制模式和位置、抗原表达以及炎症环境等有关。
Tmem细胞的一个关键特性:通过细胞因子IL-7和IL-15,以不依赖抗原的方式,维持细胞的功能及稳态自我更新。
在慢性感染过程中,病毒特异性的Tex细胞,由于IL-7Rα和IL-2/15Rβ信号通路的缺陷,无法通过IL-7和IL-15介导稳态自我更新。
Tex细胞增殖是通过持续的抗原信号来维持的。但Tex细胞会失去对额外增殖信号的反应能力,并且对未来的相同抗原刺激没有反应,导致记忆稳态的丧失,也是人类Tex细胞的一个特征。
Tex细胞的一个关键特征是多IRS的增加和持续表达。免疫检查点抑制剂可以部分地逆转T细胞耗竭。
近些年,越来越多的抑制性受体被发现,见下表:
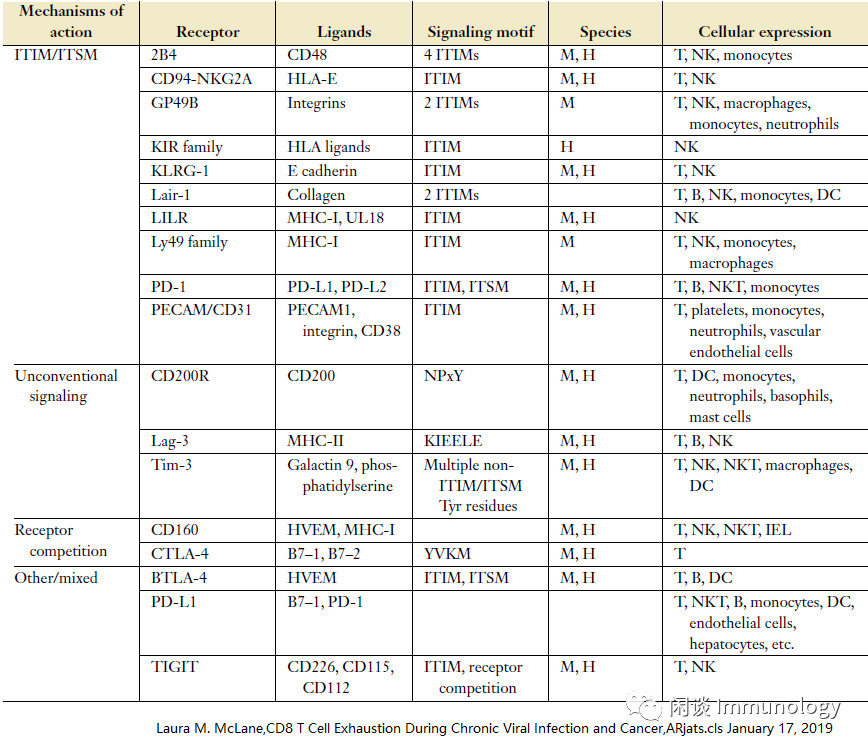
抑制性受体,在Teff有短暂表达,以确保在其发挥完作用后,功能被抑制,维持免疫稳态,避免自身免疫性疾病。
在许多慢性感染和癌症中,多个IRS的共同表达是Tex细胞的共同特征,因而联合靶向是目前治疗癌症的主要临床治疗策略。
Tex细胞的转录图谱显示代谢失调。在体外,PD-1交联减弱PI3K、Akt和mTOR信号,直接影响代谢途径,包括抑制糖酵解。在体内,发育中的Tex细胞表现出代谢紊乱,包括抑制细胞呼吸、降低葡萄糖摄取和线粒体能量失调。
PD-1阻断可以恢复合成代谢,增强葡萄糖摄取,导致肿瘤微环境中葡萄糖的增加。
与Teff和TMEM细胞相比,Tex细胞现在被认为有一个独特的转录程序。基因表达的变化包括编码IRS,转录因子,控制TCR信号通路、共刺激和细胞因子信号以及细胞代谢。
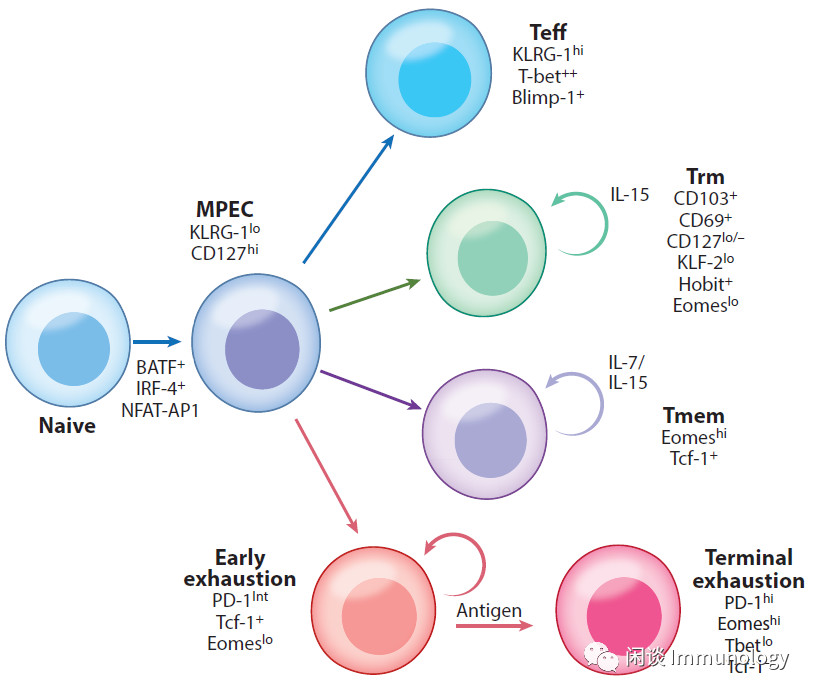
慢性感染或癌症的一个关键特征是T细胞持续接触抗原,高抗原负载和长时间的抗原暴露都会导致更严重的T细胞衰竭。
促进T细胞耗竭的细胞因子
IL-10
IL-10是一种STAT3诱导的细胞因子,常与减弱T细胞活化有关。阻断IL-10可预防和/或逆转T细胞耗竭。多种免疫细胞类型,包括树突�