
干细胞的出现极大地推动了再生医学的发展,涵盖了基于细胞的高通量药物筛选、细胞移植和器官移植等应用领域,展现了广阔的应用前景。干细胞行业,尤其是间充质干细胞治疗的快速发展,方兴未艾。
随着对间充质干细胞治疗机理的深入研究,研究发现间充质干细胞通过外泌体来发挥治疗作用,从而推动了干细胞外泌体的研究和发展。

2013年,诺贝尔生理学或医学奖授予了三位科学家,表彰其在细胞间囊泡运输调控机制领域作出的突出贡献。诺奖的肯定,使得胞外囊泡及其生理学功能成为热点,得到广泛研究。
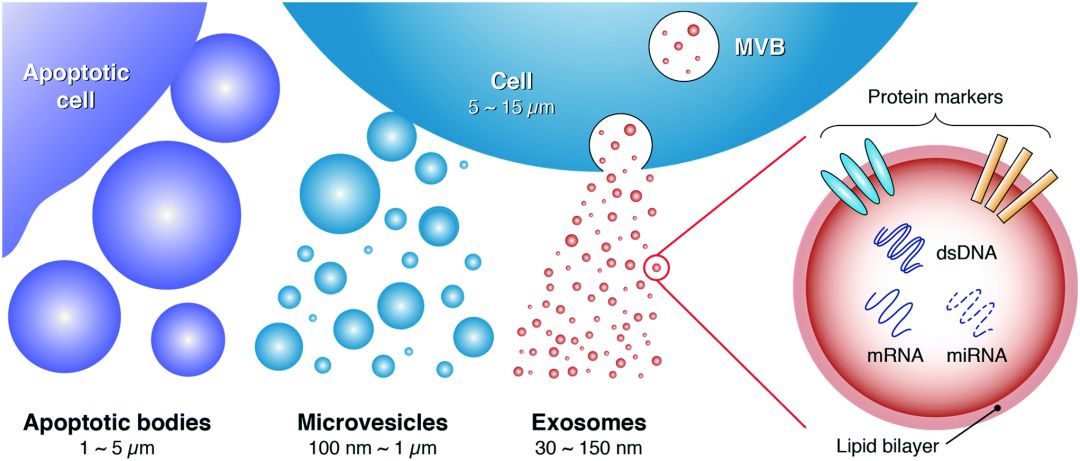
不同类型的细胞均可通过出芽方式释放各种各样的囊泡(如外泌体、微囊泡、凋亡小体)到细胞外,囊泡大小从40nm到毫米不等,统称为胞外囊泡(Extracellular Vesicles,EV)。
EV的外层为磷脂膜,内层由特定类型的蛋白质组成,包括酶、生长因子、受体、细胞因子、脂质、RNA和代谢物。直径30~150nm的胞外囊泡,即为外泌体(exosome)。
早在20世纪60年代,EV的生理特性得到阐述,EV可在细胞、器官之间,甚至有机体之间传递信息,在血液、尿液、脑脊液、母乳和唾液等体液中均能检测到。具有运输和转移生物活性分子,介导靶向细胞间信号传递、遗传信息的功能性转移等作用。
间充质干细胞(MSC)分泌大量的EV,EV内容物包括蛋白和RNA(>80%),以及一些小RNA,其中miRNAs约44%、tRNA约47%。MSC通过EV与其他细胞实现信息交流,发挥治疗作用。MSC-EV可表达MSC表型标记,如CD29、CD73、CD44和CD105。
已在MSC-EV中发现850多个独特的基因产物和160多个miRNAs。

MSC-EV已在几种不同类型的疾病中显示出令人鼓舞的治疗效果,包括肾损伤、心脏损伤、脑损伤和肝肺损伤等。主要机制可能是MSC-EV介导了MSC的旁分泌/自分泌机制。
急慢性肾损伤方面,MSC-EV中的生长因子mRNA可转移到顺铂损伤的近端肾小管上皮细胞(PTEC),促进PTEC增殖;IGF-1R的mRNA通过体外水平转移到肾小管上皮细胞,增强了肾小管细胞对局部产生的IGF-1的敏感性。如果骨髓MSC-EV的miRNA耗竭,则在急性肾损伤中MSC-EV的再生修复能力显著降低,提示在急性肾损伤恢复中,miRNAs起着关键作用。
心肌梗死方面,体外扩增的MSC培养上清液已成功用于缩小小鼠心肌梗死范围。MSC上清液的促再生活性被证明为EV组分,去除EV后则没有作用效果。MSC-EV介导的细胞保护作用可减轻大肠杆菌内毒素诱导的小鼠急性肺损伤和低氧诱导的肺动脉高压。MSC-EV还展示了减轻药物诱导肝损伤和肝纤维化的能力。
MSC-EV可直接促进血管生成。在大鼠模型中,MSCEV可显著改善后肢缺血灌注,加速皮肤烧伤后的再上皮化,并提高同种异体皮肤移植物的存活率。在中风模型缺血性闭塞后,MSC-EV给药可促进功能恢复和新生血管,显著改善卒中诱导后的功能,但是MSC组和MSC-EV组没有明显的疗效差异。
在绵羊模型中,应用MSC-EV可观察到大脑缺氧损伤的改善。miRNA-133b似乎与MSC-EV介导的大鼠缺血性卒中后的功能恢复有关,而miRNA-22似乎与MSC-EV介导的缺血性心脏病心肌细胞的抗凋亡作用有关。
因此,MSC-EV可用于中风的治疗,作为干细胞输注的替代方法,改善神经预后,增加血管与神经生成。
MSC-EV对多种类型的免疫细胞均具有免疫调节作用,包括树突状细胞、T细胞、B细胞和巨噬细胞。在关节炎模型中,MSC-EV体内炎症抑制作用比MSC更强。
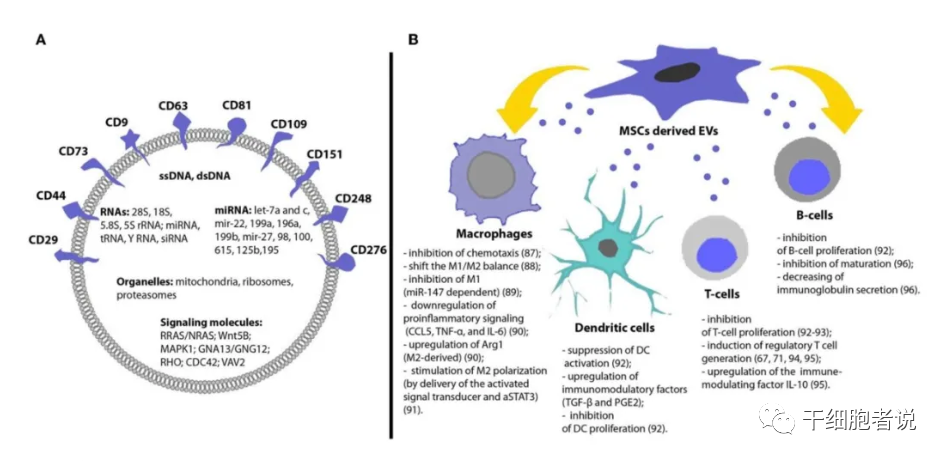
MSC-EV的免疫调节作用包括:1)通过miRNAs介导DC的免疫调节;2)通过增强M2巨噬细胞极化和间接驱动T细胞诱导发挥免疫抑制作用;3)抑制健康供者和GvHD患者NK细胞和其他外周白细胞的激活;4)在体外与PBMC共培养时抑制T细胞的激活,促进调节性CD4+、CD25+、FOXp3+、T细胞的增殖;5)高度表达GVHD改善相关的多种可溶性因子,静脉输注MSC-EV可抑制CD4+T和CD8+T细胞的活化和浸润,从而延长GVHD小鼠模型的存活时间,并减少多个器官的病理损伤。
在小鼠体内的生物发光和荧光介导的断层成像显示,EV静脉注射主要分布在脾、肝、肺和肾,30分钟内在脑、心脏和肌肉中可检测到EV,60分钟后尿液中可检测到EV。
已经观察到,MSC-EV的促肿瘤和抗肿瘤作用,目前尚无给药的任何副作用报道,可以认为MSC-EV给药基本上安全,且由于EV不能自我复制,无内源性肿瘤形成潜力。
2011年,进行了第一次有记录的临床MSC-EV给药,MSC-EV以递增的剂量应用于1例类固醇耐药的GVHD患者,4×107个MSC培养上清液分离的MSC-EV(1.3-3.5×10*10个颗粒或0.5~1.6mg)被定义为1个单位,每隔2~3天静脉注射一次,共2周,总共接受4个单位,GVHD症状显著下降,每日类固醇剂量可从125mg减少到30mg,治疗后稳定了5个月,MSC-EV给药耐受性良好,未观察到副作用。
对20例慢性肾脏病患者进行的Ⅱ/Ⅲ期临床研究表明,脐带MSC-EV(输注2次,相隔1周)可改善肾小球滤过率、血肌酐水平、血尿素和尿白蛋白肌酐比值,伴随着TGF-β1、IL-10水平明显升高和血浆TNF-α水平显著下降,没任何副作用。
MSC-EV用于8例患者牙槽骨再生研究发现,无不良反应,放射学评估显示所有病例均有早期骨形成,注射部位的炎性淋巴细胞浸润很少,研究证明MSC-EV在骨再生方面具有较大的潜力。
对7例长期存在大型特发性难治性黄斑裂孔患者,年龄51~75岁,行玻璃体切除、内界膜剥离、MSC(2例)或MSC-EV(5例)玻璃体腔内注射;5例MH闭合术患者最佳矫正视力提高,其中1例接受MSC治疗的患者在视网膜表面观察到纤维膜,1例接受较大剂量MSC-EV的患者出现炎症反应。
MSC-EV具有免疫调节活性并促进再生过程,其方式显然与MSC相当。因此,基于EV的无细胞疗法,为多种疾病提供了一种基于干细胞治疗的有前途的替代方案。与细胞疗法相比,EV疗法具有一些优势,但由于该领域的新颖性,其临床分级生产、质量保证和应用缺乏国际公认的指南。
改变MSC的培养环境,用不同的外界刺激预处理,这不仅可以影响EV的产量,还可以调节它们的成分。例如,中风患者血清培养或缺血脑组织提取液处理,都可激活MSC释放更多的EV。MSC培养时给予炎症刺激,将增强抗炎特性的EV释放。
与传统的2D培养相比,微载体3D培养中,MSC分泌更高的EV,并降低整合素的表达。3D培养在MSC-EV生产中可能优势,包括:1)需要大量的培养基才能获得大量临床使用的EV;2)持续的培养基灌流,可避免代谢副产物的积累;3)控制进出生物反应器的培养基流量可连续产出。
超速离心是收集EV最常用、最常规的方法。市面上可买到一种快速、简单的试剂盒,其分离方法相对粗糙、易引起可溶性蛋白污染。
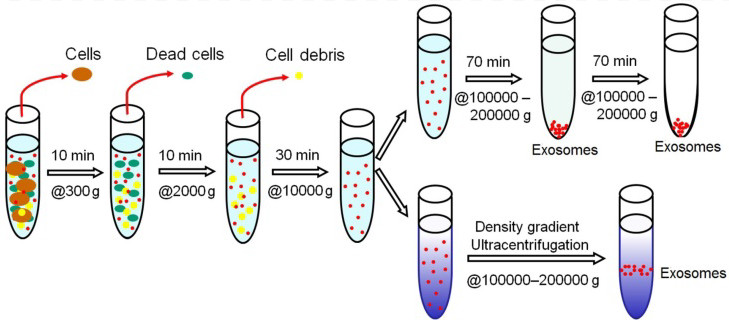
超速离心方法可获得纯EV用于科研,但在临床上耗时长,不适合大规模生产。超速离心聚集囊泡,易于分离到可溶性因子和蛋白质。基于密度梯度的分离EV,效率最高。一些新兴的技术,如尺寸排除色谱、声学分离、纳米捕捉器、流场流动分级,都有可能从不同的样品基质中分离出EV。
EV的质量保证是后续治疗的基础。虽然有研究表明,MSC-EV发挥了治疗作用,且无副作用,但必须建立适当的质量控制标准,以确保所产生的EV产品的质量、安全性和有效性得到保障。如EV应储存在等渗缓冲液中,以防止储存和冻融循环期间的pH变化。
干细胞外泌体的深入研究有助于阐述干细胞治疗的精准机制,而且干细胞外泌体有可能在治疗应用领域替代干细胞。干细胞外泌体(特指MSC-EV)是一个研究和应用都值得期待的好方向,但是需要脚踏实地地去做些工作。
因此,为了开发基于EV的药物,至少需要在以下方面产生突破:1)适用于大规模制备、纯化和储存的分离方案;2)量化、分子和物理表征的标准化方案;3)明确的临床使用质量控制标准。
本文来源于《医学参考报》干细胞与再生医学频道2020-04期第4版文章